en
names in breadcrumbs


Cowbirds prefer habitats with low or scattered trees among grassland vegetation, such as woodland edges, brushy thickets, prairies, fields, pastures, orchards, and residential areas. Fragmentation of forests has greatly increased the Brown-headed Cowbirds favorite habitat.
Terrestrial Biomes: forest
Average lifespan
Status: wild: 202 months.
The cowbird is a small blackbird with a short conical bill and long, pointed wings. Males appear black with a unique brown head and neck. Females are either dullish gray or brown throughout. The bill is a dull grey, while the eyes are black.
Range mass: 40 to 50 g.
Other Physical Features: endothermic ; homoiothermic; bilateral symmetry
Average basal metabolic rate: 0.6315 W.
Perception Channels: visual ; tactile ; acoustic ; chemical
Cowbirds breed from SE Alaska, through lower Canada, through the entire continental U.S. to central Mexico. They winter throughout this range, and also in southern Mexico and the tip of Florida.
Biogeographic Regions: nearctic (Native )
Cowbirds often feed on the ground, away from vegetation. Their main food items are seeds and arthropods. They sometimes hawk, looking for slow flying insects. In a quantitative anaylsis of the cowbird diet, it was found that nearly 75% of the diet was 'weed' seed, with most of the remaining 25% made up of grasshoppers and beetles.
The cowbird eats many insects which are pests to humans.
Fragmentation of forest habitats in North America has resulted in a great increase in the edge habitats favored by cowbirds, and a reduction (and in many places an elimination) of forest-interior habitats that cowbirds do not penetrate. As a result, a number of species of forest birds are now subject to increasing parasitism by cowbirds. Cowbird parasitism may be one cause in the general decrease in numbers of songbirds in North America.
The cowbird is common. It does, however, pose a threat to the populations of other birds, such as the Kirtland's Warbler, Black-capped Vireo, and Least Bell's Vireo, whose small populations are frequently parasitized by the Brown-headed Cowbird. This has led to programs that involve trapping of the cowbirds at specific breeding areas where other species are threatened.
US Migratory Bird Act: protected
US Federal List: no special status
CITES: no special status
State of Michigan List: no special status
IUCN Red List of Threatened Species: least concern
The Brown-headed Cowbird is a brood parasite; the female cowbird selects a host nest of another species of bird to lay her eggs in. She wanders about, parasitizing many nests and laying up to 40 eggs per season. The young are then cared for by the host. 144 different host species have been documented to rear cowbird young, so the incubation and parental care of cowbirds varies greatly depending on the nest in which they are deposited. During the various care processes for the cowbirds, however, they are always fed more often than the young of the host species. The smallest recorded host of cowbird young is the 10 g creeper, while the largest host is the 150 g meadowlark.
Key Reproductive Features: iteroparous ; gonochoric/gonochoristic/dioecious (sexes separate); sexual ; oviparous
Average time to hatching: 11 days.
Average age at sexual or reproductive maturity (male)
Sex: male: 365 days.
Average age at sexual or reproductive maturity (female)
Sex: female: 365 days.
Molothrus ater [6] tamién conocíu como tordu negru,[7][8] tordu negru común,[7] tordu cabeza marrón,[7] tordu cabeza café,[2][6][9] tordu cuquiellu,[10] vaqueru cabecicafé,[6] vaqueru de cabeza castaña[6] o boyero negru,[11] ye un ave de vezos parcialmente migratorios perteneciente a la familia de los ictéridos, dientro del orde de los paseriformes.[11] Habita en rexones de clima templáu y subtropical d'América del Norte. Ye sedentariu nes rexones australes de la so área de distribución; les aves del norte, sicasí, migren al sur de los Estaos Xuníos y a Méxicu en iviernu y tornen al so hábitat de branu en marzu o abril.[12] Trátase d'una especie abondosa y llargamente distribuyida, de comportamientu gregariu,[8] que s'alimenta fundamentalmente de granes y artrópodos.[13]
Esibe un marcáu dimorfismu sexual,[7] y ye conocíu por ser el parásitu de puesta más común d'América del norte, depositando los sos güevos en nials de más de 220 especies d'aves, amenorgando l'ésitu reproductivu y amenaciando la supervivencia de delles d'elles.[8] A pesar de compartir esta particular estratexa reproductiva con munches especies de cucos, nun ta emparentáu con ellos, sinón que se trata d'un casu de converxencia evolutiva.
Enantes del asentamientu européu, el tordu cabecicafé siguía les menaes de bisontes (Bison bison) al traviés de les Grandes Llanures,[5] y quiciabes tamién al antílope americanu (Antilocapra americana) y al uapití (Cervus canadensis).[14] El parasitismu de puesta complementaba esti estilu de vida nómade.[15] El so númberu creció cola creación de nuevos hábitats abiertos per parte de los colonizadores. Invadió los estaos a veres de los Grandes Llagos y el nordés d'Estaos Xuníos mientres el sieglu XIX.[1] Tamién se tremó escontra l'oeste, llegando a California.[1] Na actualidá, ye posible velos alimentándose en comederos p'aves n'árees suburbanes.
El tordu cabecicafé ye una especie del xéneru Molothrus y pertenez a la familia de los ictéridos, que entiende a aves paseriformes naturales d'América del norte y del sur.[2][13] Molothrus significa "vagamundu" en griegu y ater quier dicir "negru" en llatín, aludiendo al so estilu de vida nómade y a'l color predominante del plumaxe del machu.[16][17] Esisten trés subespecies reconocíes, que s'estremen principalmente pol so tamañu y pola escuridá del plumaxe de les femes, anque nun son estremables nel trabayu de campu:[18] M. a. artemisiae (Gran Cuenca),[19] M. a. ater (Mediu Oeste y este de los Estaos Xuníos)[3][5] y M. a. obscurus (desiertos del sudoeste y mariña del Pacíficu).[19] Los machos nuevos de M. a. artemisiae presenten un mayor enclín a arrexuntase en bandaes namái de xuveniles, ente que los de M. a. ater son más gustantes a xunise a bandaes d'individuos de distintes edaes.[20]
Na actualidá, dos subespecies de tordu cabecicafé reproducir en California. M. a. artemisiae probablemente siempres fuera un residente raru pel branu nes porciones del estáu incluyíes dientro de la Gran Cuenca y un visitante ivernizu tamién raru nel restu de California (Grinnell, 1915; Mailliard, 1927). Anque la so bayura aumentó, la so área de distribución caltúvose constante. Per otru llau, acordies con Laymon (1987), el estatus de M. a. obscurus camudara notablemente mientres los previos 120 años y esta subespecie sería aparentemente la responsable del sustancial amenorgamientu del ésitu reproductivu de ciertos paseriformes del Valle Central y el sur de California.[21] Cruciar ente M. a. artemisiae y M. a. obscurus tuvo asocediendo desque dambes subespecies poner en contautu na década de 1930 na Sierra Nevada; el tamañu de M. a. artemisiae amenorgar na área onde convive cola otra subespecie, que naturalmente presenta una talla menor.[3][19]
Fleischer y Rothstein (1988) afirmaron que dos subespecies morfolóxicamente distintes ocupaben les respeutives fasteres de la Sierra Nevada: M. a artemisiae sobre la fastera oriental y M. a. obscurus sobre la occidental. Les poblaciones de obscurus llegaron a California dende'l baxu ríu Coloráu alredor del 1900 ya invadieron l'oeste de la Sierra Nevada mientres la década de 1930. Poblaciones de obscurus apartaes ente sigo por distancies d'hasta 700 km producíen un xiblíu relativamente constante en vuelu, ente que los artemisiae del este presentaben numberosos dialeutos.[19]
Les midíes medies de siete mediciones morfolóxiques pa 2.287 individuos amosaben patrones similares tocantes a tamañu corporal pa machos adultos, machos d'un añu d'edá y femes dientro de segmentos llatitudinales de 60 km a lo llargo del este de la Sierra Nevada: nel puntu d'estudiu más austral en Bishop rexistráronse talles grandes, que amenorgábense gradualmente escontra'l norte hasta Mammoth Lakes y depués empezaben a aumentar nuevamente en direición norte hasta Llei Vining, el sitiu d'estudiu más septentrional.[19]
Ente que la información recoyida nun indica un orixe adaptativu pa estes variaciones, una esplicación más conservadora suxure un fluxu de xenes de obscurus nes poblaciones de artemisiae na área de Mammoth Lakes. Nun ye sorpresa que la cresta de la Sierra Nevada en Mammoth Lakes seya considerablemente menos elevada qu'en cualesquier otru puntu 80 km al norte y 180 km al sur.[19]
Otros dos descubrimientos sofitaron esti camientu. De primeres, los exemplares de mayor llargor alar (recoyíos en Bishop y en Llei Vining) presentaben nales significativamente más curties que les de los tordos cabecicafé recoyíos na mesma rexón ente 1912 y 1922. De segundes, la llongura de les nales de machos adultos y femes en Mammoth Lakes ente 1978 y 1981 yera significativamente mayor qu'el de los individuos del periodu 1982 – 1985.[19]
Esta presunta hibridación ten de ser rápida cuidao que pasaron menos de cincuenta años ente'l contautu ente dambes subespecies per primer vegada y l'empiezu del estudiu de Fleischer y Rothstein. La tresferencia de xenes producir ente dos subespecies con distintos xiblíos en vuelu y ente dellos dialeutos de xiblíos dientro de artemisiae. Poro, les diferencies vocales ente estos dialeutos nun paecen ser un importante elementu disuasorio del entrecruzamiento.[19]
El tordu cabecicafé ye un ictérido pequeñu.[1][8] El machu mide 19 - 22 cm, con un pesu d'ente 42 y 50 g.[8] El llargor de la fema bazcuya ente los 16 y 20 cm y pesa 38 - 45 g.[8] Xeneralmente, el so amenorgáu tamañu ye abondu pa estremalo d'otres especies en bandaes mistes, inclusive cuando la so coloración nun ye estremable.[17] El picu ye cónicu,[1][13] más curtiu y de base más ancha que n'otros ictéridos,[8] negru nel machu y na fema escuru na metá cimera y maciu nel quexal inferior.[18] Los güeyos son escuros y les pates, negres.[18] Les nales son llargues y en punta.[1][13] El so cola ye más curtia —una carauterística distintiva en vuelo— y la so cabeza, más robusta que na mayoría de los miembros del so familia.[8]
El plumaxe del machu adultu ye predominantemente negru iridiscente, cola cabeza, el pescuezu y el pechu marrones,[7][11] lo que lo estrema d'especies similares tales como'l tordu güeyu coloráu (Molothrus aeneus) y el tordu renegrido (Molothrus bonariensis).[8] Vistu na lluz, la so iridiscencia ye menor que la de los zanates (Quiscalus spp.) y la del tordu güeyu mariellu (Euphagus cyanocephalus).[8] La fema, de color marrón o gris, presenta una tonalidá más escura sobre les nales y cola[18] y más clara sobre la cabeza y el banduyu, con fines vetes nel abdome y pechu, muncho más sutiles que les de la fema de tordu sarxentu (Agelaius phoeniceus).[8] El so gargüelu ablancazáu oldea cola so cara más escura.[18] Inclusive ella presenta nicios de iridiscencia verdosa, anque la so coloración más apagada brínda-y un bon camuflaje mientres busca niales nos que depositar los sos güevos.[16][22] Los xuveniles son más veteados y claros que les femes adultes,[18][23] y les puntes de les sos plumes son más pálides, lo que-y da al so envés una apariencia escamosa.[18][24]
Los cambeos nel plumaxe del tordu cabecicafé son abondo simples. El plumón natal foi caracterizáu pol ornitólgo Jonathan Dwight (1900) como oliva abuxáu. Describió'l plumaxe xuvenil, común a dambos sexos, de la siguiente manera: “Enriba, incluyendo les bandes de la cabeza y el pescuezu, les nales y la cola, oliva amarronáu escuru, les plumes con un cantu beige claro, blancuciu sobre les primaries. Embaxo, blancu apagáu, beige sobre'l gargüelu, pechu y lladrales con munches vetes oliva amarronáu. El mentón ye blancu o amarellentáu.” N'agostu o a empiezos de setiembre produz una muda postnupcial completa, dando llugar al primer plumaxe d'iviernu que ye indistinguible del de los adultos. Mientres camuden les sos plumes, los machos nuevos vuélvense llamativos por cuenta de que les polenques plumes negres del so nuevu plumaxe remanecen espardíes ente les vieyes plumes marrones, dándo-yos una interesada apariencia motuda. Nel machu, la cabeza, el pescuezu y la nuca son d'una especie de marrón violáceo, pero'l restu del plumaxe, incluyendo les nales y la cola, ye d'un negru polencu con reflexos verdes y púrpures. La fema adquier la so coloración gris mure”. Los adultos traviesen una muda total en setiembre pero nun sufren una muda prenupcial,[17] a diferencia de lo qu'asocede col tordu arroceru (Dolichonyx oryzivorus).[25]
El tordu cabecicafé ye una especie neártica orixinaria de les Grandes Llanures. El so área de distribución tuvo en constante crecedera mientres los sieglos XIX y XX y anguaño cubre la mayor parte del territoriu estauxunidense y mexicanu y grandes estensiones nel sur y oeste de Canadá. El so númberu aumentó cola deforestación de los montes, la introducción de nuevos animales de pasturas per parte de los colonizadores europeos, la urbanización y la conversión de los hábitats montiegos en terrenes agrícoles.[1][14] Pa fines de la década del 2000 o principios de la de 2010, la so área de distribución —incluyendo tantu les zones de reproducción como les de migración iverniza— estendíase sobre aprosimao 11.200.000 km²,[26] lo qu'equival a un 46% de la superficie norteamericana. A pesar de la idea comúnmente aceptada de que nun principiu habitaba namái nes Grandes Llanures, la esistencia de tres subespecies distintes podría suxurir que la so área de distribución orixinal yera más amplia.[18]
Graham (1988) y Rothstein (1994) identificaron al tordu cabecicafé como la especie qu'esperimentara la mayor espansión na so distribución ente toles aves norteamericanes.[27] Nel sieglu XIX, arrobinar pol este d'América del norte.[28] Mientres el sieglu XX, tremar escontra l'oeste, faciendo que la so área de distribucìón cubriera entós los 48 estaos americanos allegantes y tol sur de Canadá.[22] La conquista de los estaos occidentales deber en gran parte a la rápida colonización del M. ater obscurus.[3][21][29] Afirmóse que'l fechu de que les árees de reproducción y alimentación tean dixebraes ente sigo contribuyó de manera importante a esta espansión.[3][29] Por cuenta de que los tordos cabecicafé pueden volar hasta 7 km ente unes y otres, el surdimientu de nuevos hábitats nos qu'alimentase (corroladaes de caballos, zones residenciales con comederos p'aves, etc.) dientro de lo qu'antes yera monte zarráu supunxo consecuentemente l'usu de nueves árees pa reproducise.[3][29]
Enantes del 1800, el tordu cabecicafé habitaba fundamentalmente nes praderíes al oeste del ríu Misisipi. Nun se-y atopaba nes vastes estensiones de monte ininterrumpíu que cubríen gran parte del este d'América del norte por cuenta de que los sos vezos alimenticios y el so comportamientu social acutar a hábitats abiertos. A midida que los pobladores baltaben los montes orientales y estenaben el terrén pal so usu n'actividaes agropecuaries, aniciáronse nuevos hábitats abiertos, que favorecieron una espansión escontra l'este per parte del tordu cabecicafé. Aparentemente, escontra fines del sieglu XIX, la especie espardiérase pel este d'América del norte, pero nun yera abondosu y vivía principalmente n'árees cultivaes. Nun yera común en hábitats montiegos y, nesi entós, l'impautu del so parasitismu de puesta sobre l'ésitu reproductivu de los paseriformes del monte yera probablemente mínimu.[28]
En 1958, Arthur Cleveland Bent determinó que los valles de los ríos Potomac y Ohio yeren les llendes septentrionales de la área de distribución iverniza regular del tordu cabecicafé oriental, que estendíase hasta Florida y la mariña del Golfu de Méxicu.[17]
Nun se sabe a ciencia cierta si M. a. obscurus habitaba a veres del ríu Coloráu enantes de 1870, cuando foi documentáu reproduciéndose ellí per primer vegada (Laymon, 1987). Sicasí, esiste un únicu rexistru al oeste d'esi ríu anterior a 1870: na fastera esti de les montes Cuyamaca (condáu de San Diego, estremu sudoeste de California) en 1862. Según los rexistros, la so área de distribución espandióse rápido escontra l'oeste y el norte ente 1900 y 1930. Para 1925 yera común na área de Los Angeles y para 1930 espardiérase a la área de la badea de San Francisco y el valle de Sacramento central. Para 1941 tremárase pol condáu de Humboldt (noroeste del estáu) y para 1960, algamáu'l condáu de Del Norte (estremu noroeste), la llende con Oregón y los praos de mayor altitú de la Sierra Nevada.[21] Rothstein y otros (1980) documentaron la recién espansión na área de distribución del tordu cabecicafé na Sierra Nevada, alvirtiendo que l'ave nun yera columbrada ellí enantes de 1930, pero paecía tar llargamente distribuyida aquel día sobre la mayoría o la totalidá de les monatañas.[30]
En términos relativos, podría dicise que los tordos cabecicafé son acabante llegar en Washington. Magar pudieron tar presentes ellí en pequeños númberos dende enantes, xeneralmente considérase qu'aportaron a la cuenca de Columbia a finales del sieglu XIX. Para 1955 yeren vistos con regularidá nel oeste de Washington, y para 1958 yá se reproducíen nesa zona del estáu.[31]
Desconozse la fecha esacta de la llegada del tordu cabecicafé a Columbia Británica. El primer rexistru, procedente de la área de Revelstoke, foi de mayu de 1890. Reportar más tempranos d'esta ave fueron del sur de la provincia ya inclusive para 1930 la mayoría de los rexistros correspondíen a les zones meridionales del interior (esto ye, el sur y el sudeste de Columbia Británica). Para 1950, el tordu cabecicafé fuera documentáu nes ecoprovincies interior central (centro-sur de Columbia Británica) ya interior sub-boreal (centro-norte), pero entá yera una especie rara a lo llargo de la mariña. Eso camudó a finales de la década de 1950 y principios de la de 1960, y para 1970 el tordu cabecicafé podía ser atopáu en hábitats fayadizos en toa'l llargor de la mariña, incluyendo gran parte de la isla de Vancouver. Coles mesmes, yera rexistráu en más sitios y probablemente la so bayura aumentaba nel interior de la provincia al sur del paralelu 56° norte. Para 1990, podía topáse-y en toa Columbia Británica, incluyendo les zones más septentrionales de los montes boreales del norte (norte y noroeste de la provincia) y de les llanures de taiga (nordés).[27]
Na actualidá, la so área de reproducción estiéndese dende'l sudeste d'Alaska, norte de Columbia Británica, sur de los Territorios del Noroeste, norte d'Alberta y centro-norte de Saskatchewan, escontra l'este hasta'l sur de Manitoba, d'Ontario, de Quebec y de Terranova,[32] Nuevu Brunswick, Nueva Escocia y la Islla del Príncipe Eduardo (Canadá),[33] cubriendo tolos Estaos Xuníos continentales, hasta Florida central y la mariña del Golfu, siguiendo escontra'l sur de Méxicu —Oaxaca y Veracruz—[27] y, nel noroeste de dichu país, hasta'l norte de Baxa California.[3][13][34] Según Peter Y. Lowther (1993), añera tamién nel sudeste del territoriu canadiense de Yukón.[5][33] El so parasitismu foi detectáu inclusive en niales de gorriones de Ipswich (Passerculus sandwichensis princeps) sobre la remota isla Sable, al sudeste de Nueva Escocia (Stobo y McLaren, 1975).[35]
Acordies con Richard M. DeGraaf y otros (1991), pasa l'iviernu dende'l norte de California, Arizona central, los estaos a veres de los Grandes Llagos y Nueva Inglaterra, escontra'l sur hasta Méxicu meridional,[7] la mariña del Golfu y l'estremu de la península de Florida.[3][13][36] Otres fontes inclúin tamién na so área de distribución iverniza'l sudoeste de Columbia Británica, oeste de los estaos sobre l'océanu Pacíficu, sur d'Utah, porciones meridionales d'Ontario, Nuevu Brunswick y Nueva Escocia.[27] Según Peterson y Chalif (1989), habita en tol territoriu mexicanu, sacante en Chiapas, Tabasco, Campeche, Quintana Roo y Yucatán.[7] Magar mora mientres l'añu enteru nel sur de los Estaos Xuníos, puede topáse-y en rexones septentrionales y montascoses namái mientres la temporada reproductiva.[1]
Según información de la Seattle Audubon Society pa la década del 2000, ye posible atopalo mientres los meses ivernizos nos feedlots del este de Washington. Coles mesmes, nel oeste de dichu tao, grandes cantidaes de tordos cabecicafé son vistes mientres tol añu pela redolada de Kent (condáu de King).[31]
Acordies con un estudiu de Root y Weckstein (1994) basáu n'información recoyida mientres bona parte del sieglu XX, el so área de distribución iverniza estendiérase escontra la rexón nordeste (Maine y Nueva Escocia), amenorgándose n'otros llugares a lo llargo de les llendes septentrionales de la mesma (Pennsylvania, Michigan, Wisconsin, Iowa, Montana y Washington). Les razones qu'espliquen esti amenorgamientu son de xuru complexes, pero unu de los factores más relevantes pudo ser el control poblacional al traviés de la captura con trampes mientres la temporada reproductiva en Michigan, per parte del Serviciu de Pesca y Vida Montesa de los Estaos Xuníos y el Departamentu de Recursos Naturales d'esi estáu con cuenta de caltener al chipe de Kirtland (Dendroica kirtlandii), amenazáu pol parasitismu. Para 1980, esaniciárense yá 40 mil exemplares de la especie parasítica.[37]
Según datos publicaos en 1993, la tasa de supervivencia añal de los adultos ye d'un 48,5% pa los machos y 40,4% pa les femes.[3][5] La fecundidá d'una fema promediu na so vida entera ye de 80 güevos,[3][5] unos 40 per añu a lo llargo de dos años.[38] Los estudios probaron que namái un 3% de los güevos de tordu cabecicafé va producir pitucos que lleguen a la adultez, lo cual compénsase cola gran cantidá de güevos depositaos, dando una descendencia promediu de 2,4 exemplares adultos por fema.[23][38]
Acordies con l'ornitólogu Arthur Cleveland Bent (1958), la prevalente impresión de que los machos superen llargamente a les femes en númberu probablemente seya más aparente que real por cuenta de que los primeres son más llamativos y menos reservaos. L'ornitólogu Herbert Friedmann (1929) concluyó de les sos observaciones qu'habría unos trés machos per cada dos femes.[17] Rothstein y otros (1986) y Yokel (1989) mentaron que los machos representaben un porcentaxe sensiblemente mayor al de les femes sobre la población total de la especie, lo cual probablemente significaría que numberosos machos presentes nes árees de busca de niales nun tengan pareya y en realidá tean procurando una compañera.[14]
Les estimaciones de la so población total en América del norte variaben ente los 20 y los 40 millones d'individuos para 1972. Nesi mesmu añu, calculóse que'l númberu de tordos cabecicafé en Dakota del Norte sería d'un millón d'exemplares.[3][39] La población envalorada para 1957 en Illinois yera d'aprosimao 1,1 millones.[3] Otres estimaciones remanen una cifra d'alredor de 56 millones d'individuos maduros para 2010, distribuyíos nuna área de 11.200.000 km².[16][26] Por cuenta de la so bayura, considérase-y una especie so esmolición menor.[8][26]
El norte de les Grandes Llanures ye la área con mayor bayura de tordos cabecicafé n'Estaos Xuníos y Canadá.[14][33] Acordies con Robinson y otros (1993), ente los 48 estaos allegantes los tordos cabecicafé son más abondosos en Dakota del Norte, Dakota del Sur, Nebraska, Kansas y Iowa; bien abondosos en Oklahoma y Misuri; moderadamente abondosos en Washington, Oregón, Idaho, Montana, Arizona, Texas, Luisiana, Arkansas, Misisipi, Tennessee, Kentucky, Maryland, Ohio, Indiana, Illinois, Michigan, Wisconsin y Minnesota; y más escasos en California, Nevada, Utah, Wyoming, Coloráu, Nuevu Méxicu, Alabama, Florida, Xeorxa, Carolina del Norte, Carolina del Sur, Virxinia, Virxinia Occidental, Pennsylvania, Delaware, Nueva Jersey, Nueva York, Connecticut, Rhode Islland, Massachusetts, Vermont, Nuevu Hampshire y Maine.[14]
Acordies con Laymon (1987), les mayores concentraciones de tordos cabecicafé en California pel hibiernu danse nel Valle de Sacramento, el Valle Imperial, l'oeste del condáu de Riverside y el sudoeste del de San Bernardino.[21] Quiciabes por cuenta de la proximidá ente les árees d'alimentación y les de busca de niales, tienden a ser más abondosos n'hábitats heteroxéneos estazaos nos que se combinen superficies cubiertes de verde con campos arbustivos en desusu y/o montes.[14]
Delles investigaciones sostienen que les poblaciones de tordos cabecicafé crecieron a lo llargo del sieglu XX na mayor parte d'Estaos Xuníos. Nel nordés, sicasí, sufrieron un amenorgamientu estadísticamente significativa.[14][40] La información de Breeding Bird Survey (BBS) d'ente 1965 y 1979 indicaba que'l númberu de tordos cabecicafé amontárase nel sudeste estauxunidense, incluyendo Carolina del Norte, Carolina del Sur y el sur de Xeorxa.[3][41] Margaret Clark Brittingham y l'ecoloxista aviar y biólogu de vida montesa Stanley A. Temple (1983) concluyeron que la cantidá d'exemplares tuviera creciendo costantemente ente 1900 y 1980 nos once estaos meridionales al sur del paralelu 37° norte dende Texas hasta'l océanu Atlánticu, a onde la mayoría d'exemplares del este migra pa pasar los meses ivernizos. Esti aumentu na so bayura probablemente débase a una mayor disponibilidad d'alimentu y de hábitats nos que pasar l'iviernu. Los granos residuales que queden espardíos sobre los campos d'arroz (Oryza sativa) nos estaos sureños constitúin una importante fonte d'alimentu pa delles especies d'ictéridos, incluyendo'l tordu cabecicafé, nesa dómina del añu,[28] lo cual podría repercutir nuna mayor tasa de supervivencia al iviernu.[14][22] Una medría nel so ésitu reproductivu deriváu de la esposición a nueves y vulnerables especies hospedadoras posiblemente tamién tea rellacionáu con esti enclín.[14][22]
Conforme a un estudiu publicáu en 1993, les poblaciones d'esta especie taben amenorgándose en Arizona, aumentando llixeramente en Idaho y amontándose marcadamente en Montana.[3][42] En Oregón, crecieron nos montes de sabines (Juniperus) ente 1899 y 1983, pero menguaron considerablemente nel estáu polo xeneral.[3][5][43] Na Sierra Nevada, aumentaron ente 1966 y 1985.[3][44] Los datos de Breeding Bird Survey pal Mediu Oeste suxuren un decrecimiento pal periodu 1966 - 1981 y una medría ente 1982 y 1991.[3][45] Según Peter Y. Lowther, aumentos demográficos significativos (información de BBS 1966 - 1987) dar en Xeorxa, Carolina del Norte, Iowa, Dakota del Norte, Utah y Coloráu, ente que se rexistraron amenorgamientos significativos en Minnesota, Michigan, Wisconsin, Nueva York, Rhode Islland, Ohio, Ontario (Canadá), Virxinia Occidental, Tennessee, Nuevu Brunswick (Canadá), Oklahoma y Texas.[3][5] Magar la so población menguó considerablemente en Washington ente 1966 y 2002, entá son comunes y atópense llargamente distribuyíos nel estáu.[31]
Una interpretación alternativa de la información de BBS per parte de James R. Herkert señalaría un enclín xeneralmente negativu pa los Estaos Xuníos, pero una marcada crecedera en Illinois mientres el periodu 1966 - 1991.[3][46] Según la National Geographic (2006), el so númberu tuviera en descensu apocayá.[18] Butcher y Niven (2007) argumenten que la especie sufrió un amenorgamientu pequeñu o estadísticamente insignificante na so población n'América del norte nel so conxuntu mientres les últimes cuatro décades.[26]
Les observaciones de tordos cabecicafé nel interior de la Columbia Británica caltuviéronse relativamente estables dende la década de 1930 hasta la de 1950, ente que los avistamientos sobre la mariña —onde proporcionalmente hai más observadores— fueron escasos ente los años 1930 y 1940, pero empezaron a amontase en los ‘50 a midida que les aves empezaben a colonizar estes árees. Importantes aumentos nel númberu de avistamientos y na cantidá d'exemplares por avistamiento producir na década de 1960. En los ‘80, esti enclín positivu caltener nel interior, pero revertir na mariña.[27]
Un analís de la información de les Breeding Bird Surveys na Columbia Británica pal periodu 1968 – 1993 amuesa que'l númberu de tordos cabecicafé sobre la mariña menguara un 4% añal en promediu; nun analís de los datos del interior de la provincia pal mesmu periodu, nun se detectaron cambeos netos na cantidá d'individuos. A lo llargo de Canadá, los datos de les BBS indiquen un amenorgamientu poblacional; dende 1960 a 1996, el so númberu cayó en promediu un 2% cada añu. Na totalidá de la so área de distribución, la información suxure qu'el so cantidá amenorgó un 0,8% añal promediu nel mesmu periodu (Sauer y otros, 1997).[27]
Alcuéntrase-y en hábitats abiertos y semiabiertos, incluyendo árees d'eses carauterístiques nes cercaníes de terrenes agrícoles,[1][7] marxes de montes,[7][13] bosque de coníferes y caducifolios pocu mestos,[1] carbes,[1] vexetación riberana,[7] praderíes y praos,[13] cultivos de frutales[13] y árees residenciales.[1][13] Xeneralmente, evita los montes tupios y ensin escamplaes,[1][8] pero espolleta naquéllos más estazaos.[28] En Kansas, un censu lleváu a cabu ente 1974 y 1988 reveló qu'había 6 tordos cabecicafé por km² nes praderíes de camperes altes, pero tan solo 1 por km² nos güelgaes axacentes.[3]
Los tordos cabecicafé son capaces d'esplotar los ambientes modificaos pol home particularmente bien por cuenta de la gran variedá d'alimentos que peracaben y la so adaptabilidá a nuevos hábitats.[22] P'alimentase, precisen árees con vexetación baxa.[33] Prefieren les zones nes qu'haya ganáu onde pueden consiguir tanto inseutos como granos, pero tamién aprovechen bagazos qu'atopen en cámpings, árees de picnic, etcétera. Por cuenta de que nun curien de los sos pitucos, les árees d'alimentación pueden tar alloñaes de les de reproducción, lo que-y dexa a les femes d'esta especie esplotar distintos hábitats sobre grandes distancies.[22] Sicasí, les zones nes aliméntense y depositen los sos güevos tamién pueden superponerse, particularmente nel este de la so área de distribución.[47][48]
Los sitios nos que posase constitúin un elementu importante dientro de los hábitats de los tordos cabecicafé, cuidao que los machos canten y esíbense dende ellí y les femes utilizar pa buscar güéspedes pa los sos güevos. Estos sitios inclúin árboles, parrotales y otres estructures qu'entepasen l'altor promediu de la vexetación circundante. En Alberta, Biermann y otros (1987) repararon individuos posaos n'árboles d'hasta 4 metros d'altor; non asina n'árees ensin árboles apoderaes pol parrotal Artemisia tridentata.[33]
En Wisconsin, de 1375 avistamientos ente 1995 y 2000 nos que se rexistró'l tipu d'hábitat nel que foi reparáu, el 25% dar en zones de pandu con parrotales de madera duro (particularmente sebes) o parrotales mistos, 23% n'árees urbanes, 19,5% en zones de pandu con montes de madera duro (n'especial carbayos) o montes mistos, y 14% n'árees abiertes de pandu.[47] En Michigan, un terciu de les observaciones ente 1983 y 1988 producir en hábitats residenciales, a la banda de caminos y rutes y en sebes.[47][49] Nun estudiu lleváu a cabu en Illinois, Robinson y otros (1999) afayaron qu'había menos femes de tordu cabecicafé nos pacionales (alredor de 1,25) por cada 100 güéspedes d'especies receptives para colos sos güevos que nos montes (3,75), sabanes (12,5) y carbes (5).[33]
La bayura de tordos cabecicafé puede trate influyida poles carauterístiques de la vexetación, tal como lo comprobaron numberosos estudios realizaos en distintos estaos del norte de les Grandes Llanures. En Nebraska, el númberu d'exemplares taba positivamente rellacionáu al altor de la vexetación (King y Savidge, 1995). En Minnesota, Montana, Dakota del Norte y Dakota del Sur, la densidá de la so población yera menor n'árees cubiertes con verde y llegumes (Johnson y Schwartz, 1993 a). En praderíes de campera mista quemaes nel noroeste de Dakota del Norte, yeren más abondosos en presencia de plantes herbales, vexetación viva y asociaciones del parrotal Symphoricarpos occidentalis y especies de verde tales como Elytrigia repens y Bromus inermis (Madden, 1996).[33]
Nos campos de pasturas de Dakota del Norte surcentral y noroccidental esistía una mayor cantidá d'exemplares nes formaciones vexetales apoderaes por un amiestu de campera azul de Kentucky (Poa pratensis) y especies natives de verde. La so bayura taba negativamente acomuñada a la densidá de los parrotales y a un llechu de la planta licófita Selaginella trupa, y yera baxa nes árees apoderaes namái por especies natives de verde. Coles mesmes, el principal elementu determinante de la so bayura yera una escasa obstrucción visual, amestada al altor y la densidá de la vexetación (Schneider, 1998).[33]
En Coloráu, Montana, Nebraska, Dakota del Norte, Dakota del Sur y Wyoming, altes densidaes de tordos cabecicafé alcuéntrase en zones moderadamente utilizaes como pasturas nes qu'hubiera campera azul de Kentucky y la planta herbal Artemisia ludoviciana (Kantrud y Kologiski, 1982). Nel centru de Dakota del Norte, había una mayor cantidá d'ellos n'árees cubiertes nun 30 – 80% de Symphoricarpos occidentalis y Elaeagnus commutata que n'árees cubiertes por parrotales en menos d'un 10% (Arnold y Higgins, 1986). En Iowa el so númberu a les bandes de rutes y caminos yera inversamente proporcional al altor de la vexetación y a la densidá vertical de la mesma (Camp y Best, 1993). En hábitats riberanos, la densidá de la so población taba negativamente rellacionada a la densidá de los árboles y positivamente venceyada a los árboles pequeños y a la estratificación vertical de la vexetación de menos de 3 metros (Stauffer y Best, 1980). Young y Hutto (1999) atopar con qu'en Montana y Idaho yeren más comunes n'aérees abiertes, como pacionales y terrenes agrícoles, y n'árees riberanes que nos montes.[33]
La distancia a los terrenes agrícoles, como praos, tien una fuerte inflúi sobre la presencia de los tordos cabecicafé (Goguen y Mathews, 1999). En Nuevu Méxicu, la so bayura y tases de parasitismu en niales de víreo plomizu (Vireo plumbeus) amenorgar cola distancia de los praos viviegamente utilizaos como pasturas pa los animales, dende un 81% de 58 niales nesos praos a 33% de 24 niales allugaos a ente 8 y 12 km d'ellos (Goguen y Mathews, 2000). Nuna área agrícola de Misuri, la densidá de tordos cabecicafé alimentándose yera mayor en feedlots, siguíu por verde curtiu (2 a 20 cm) usáu como pasturas, verde llargu (5 a 30 cm) emplegáu pal mesmu fin y hábitats non utilizaos como pasturas, siendo estos últimos verde cortáu, campos de segáu con campera d'ente 2 y 10 cm y campos de segáu ensin cortar con campera de más de 30 cm (Morris, 1996; Morris y Thompson, 1998). Les tases de parasitismu yeren más altes nun prau que fuera pocu utilizáu como pastura (58% de 93 niales) que nuna área montesa que nun fuera emplegada pa tal fin (22% de 139 niales) en Manitoba (Knapton, 1978). El númberu de tordos cabecicafé nel prau amenorgóse dempués de que dexara de ser emplegáu como pastura.[33]
La topografía yera un importante elementu na determinación de la so bayura nel oeste de Montana —entá ye más que la cantidá d'aves hospedadoras y el tipu de vexetación—, cuidao que se-yos topaba más frecuentemente sobre un relieve llanu que n'unu serrapatosu, en parte por cuenta de que los cañones taben más alloñaos de los terrenes agrícoles y la densidá de güéspedes ye menor ellí que n'árees llanes (Tewksbury y otros, 1999). Young y Hutto (1999) informaron que los tordos cabecicafé en Montana y Idaho yeren menos gustantes a atopase en pacionales de gran altitú; nun fueron topaos percima de los 2.318 m sobre'l nivel del mar. N'otros llugares, sicasí, fueron columbraos n'altitúes entá mayores, como en Coloráu —a 2.895 m (Hanka, 1985)— y en California, onde'l 41% de los 114 sitios nos que fueron vistos por Rothstein y otros (1980) atopábense percima de los 2.400 m sobre'l nivel del mar.[33]
Dientro de la Columbia Británica, el tordu cabecicafé ye columbráu xeneralmente n'altitúes baxes tantu sobre la mariña como nel interior. Sobre la mariña, la mayor parte de los rexistros son de les tierres baxes de la depresión de Xeorxa, anque fueron reparaos acompañando al uapití de Roosevelt (Cervus canadensis roosevelti) a altitúes de 1.370 m (Green Mountain, cerca de Nanaimo). A fines del branu, los mozos alimentar nes crestes alpines. Nel interior de la provincia, el tordu cabecicafé foi atopáu a altitúes d'ente 460 y 2440 m (al sur del llagu Tatlayoko) y los xuveniles independientes son frecuentemente vistos en praderíes alpines. Créese que la conquista d'estes altitúes elevaes na Columbia Británica ye relativamente recién, al igual que la espansión llatitudinal documentada por Rothstein y otros (1980) na Sierra Nevada y la rexistrada por Hanka (1985) en Coloráu. En dambos casos, el fenómenu atribuyir a l'alteración del hábitat causada pol intensivu consumu de la vexetación del terrén per parte del ganáu.[27]
Na Columbia Británica, el tordu cabecicafé foi documentáu parasitando niales a altitúes d'ente casi'l nivel del mar y los 335 m na mariña y ente los 280 y los 1600 m nel interior (Fonnesbeck, 1998). En toles ecoprovincias ye más abondosa n'altitúes baxes.[27]
El tordu cabecicafé escasamente salta sobre'l suelu, prefiriendo caminar o correr.[13][17] Bate les sos nales costantemente cuando vuela;[8] acordies con la descripción d'Arthur Cleveland Bent, el so vuelu paeciera ser más bien inestable, similar al del tordu sarxentu (Agelaius phoeniceus).[17] Los machos suelen posase argutos sobre les copes de los árboles de la que reproducen xiblíos y rexúntense sobre'l verde pa pavonearse y esibise ante les femes, ente que éstes de cutiu abeyen per pelos marxes de los montes en busca de nials.[8][32] Trátase d'aves ruidoses capaces de vocalizar distintos soníos.[8] Mientres canten, los machos frecuentemente enchen les plumes del so envés y pechu, llevanten los sos nales, espleguen les plumes de la so cola ya inclínense escontra alantre; dacuando faen esto en grupu.[8] Cuando nun tán esibiéndose o alimentándose nel campu, posar en cañes altes y prominentes.[8] Ye posible atopalos en xardinos llariegos, más entá si espardióse granes p'aves sobre'l suelu.[8] Ye una especie altamente gregaria en toles estaciones.[17]
Por cuenta de que los tordos cabecicafé nun curien de los sos pitucos, los sos dos principales actividaes mientres la temporada reproductiva —l'alimentación y la busca de niales— pueden llevase a cabu en sitios distintos.[14] Consecuentemente, pueden ocupar hábitats que satisfaigan namái una d'eses necesidaes y volar regularmente hasta 7 km ente les árees d'alimentación y les de busca de niales (Rothstein y otros, 1984).[14][50] Nel sur d'Illinois y el centru de Misuri, los tordos cabecicafé que buscaba niales nos montes treslladar ente 0,1 y 4,0 km p'alimentase en pasturas con ganáu, feedlots de gochos, caballos y vaques, costaos de caminos col verde curtiu, xardinos, campos apocayá llabraos y semaos, cámpings, costaos de caminos con grava, comederos d'aves y caminos de ripio.[14] Según Stephen I. Rothstein y otros (1980), los tordos cabecicafé dacuando nun se mueven de les sos árees de reproducción, si les mesmes ufiérten-yos la oportunidá d'alimentase y dormir ellí mesmu.[33]
Nel este de la Sierra Nevada, el tordu cabecicafé reproduzse y aliméntase en sitios casi totalmente distintos. Los cinco femes y cuatro de los ocho machos forníos con radiotransmisores estudiaos por Stephen I. Rothstein, Jared Verner y Ernest Stevens a principios de la década de 1980 pasaben les primeres hores de la mañana en montes abondosos en güéspedes y depués treslladábense ente 2,1 y 6,7 km hasta los llugares d'alimentación como corrolades de caballos y zones residenciales con comederos p'aves. Los cuatro machos que nun volar eses grandes distancies p'alimentase, que teníen namái un añu d'edá y posiblemente taben socialmente subordinaos, tamién amosaben una gran movilidá pero nun ocupaben les mesmes árees reproductives cada mañana. Les árees matutines de reproducción de les aves que se movíen, consideraes individualmente, teníen una estensión promediu de 68 hectárees y la suma se les sos árees de reproducción y les árees nes que s'alimentaben pela tarde ocupaben un promediu de 442 hectárees. Estes cifres atopar ente les más altes documentadas ente los paseriformes ya igualen les de delles aves de presa. El patrones de traslación de los tordos cabecicafé impliquen un cambéu radical ente un comportamientu bastante antisocial mientres la mañana y otru desaxeradamente sociable pela tarde. A diferencia d'ictéridos non parasíticos que s'alloñar dende un sitiu reproductivu central (el so nial) p'alimentase, estes aves faen lo contrario, estremándose de los sitios centrales d'alimentación pa reproducise n'otros llugares.[50]
El tordu cabecicafé ye un migrador de curtia distancia dientro d'América del norte.[3] Puede haber diferencies ente les distancies percorríes polos adultos y los xuveniles.[51] Nel nordés, la mayoría de los individuos muévese unos 800 a 850 km ente les árees de reproducción y les rexones nes que pasen l'iviernu.[3][5] Según la National Geographic, mayormente vuelen escontra'l norte ente mediaos de marzu y mediaos d'abril y escontra el sur ente fines de xunetu y ochobre.[18] Acordies con Batts (1958), Bent (1965), Knapton (1979) y Johnsgard (1980), apuerten al norte de los Estaos Xuníos dende entamos d'abril a empiezos de mayu y parten ente agostu y payares.[33] Lleguen a Connecticut en marzu y, anque dalgunos pocos pasen ellí l'iviernu, la gran mayoría migra a fines de setiembre.[23] Na Columbia Británica, el mayor númberu de tordos cabecicafé pel hibiernu alcuéntrase na ecoprovincia de la depresión de Xeorxa (este de la isla de Vancouver y estremu sudoeste de la Columbia Británica continental), y pel branu, nes ecoprovincias interior meridional (centru del sur de la provincia) y montes meridionales del interior (sudeste).[27]
Viaxen mientres el día, con frecuencia como parte de grandes bandaes compuestes por diversu especies: tordos sarxentu (Agelaius phoeniceus), zanates norteños (Quiscalus quiscula), estorninos pintos (Sturnus vulgaris) y, más raramente, tordos canadienses (Euphagus carolinus), tordos güeyu mariellu (Euphagus cyanocephalus) y malvises pechirrojos (Turdus migratorius).[3][5] Típicamente, los machos lleguen primero que les femes a les zones nes que se reproducen.[31] Según una información publicada en 1958, la migración primaveral en Maryland y el Distritu de Columbia asocede ente'l 5 de febreru y el 25 d'abril, con un picu d'actividá ente'l 10 de marzu y el 10 d'abril.[3][52] En seronda, sobre les fasteres occidentales de la Sierra Nevada, los xuveniles empiecen a formar bandaes a midida que adquieren independencia. Según datos publicaos aquel mesmu añu, los primeres xuveniles independientes apaecieron el 14 de xunetu. Na mesma área, tolos adultos partieron ente'l 17 de xunetu y el 21 de xunetu. En Maryland y el Distritu de Columbia, la migración de seronda estiéndese dende'l 15 d'agostu hasta'l 10 d'avientu, col so apoxéu ente'l 25 de setiembre y el 1 de payares.[3][52]
Según Arthur Cleveland Bent (1958), los tordos cabecicafé orientales nun viaxen enforma na so migración de primavera, dexando los estaos sureños mientres marzu p'algamar les partes septentrionales de la so área de reproducción nes primeres dos selmanes d'abril y dacuando enantes del final de marzu. Herbert Friedmann (1929) escribió que comúnmente migraben en compañía de tordos sarxentu (Agelaius phoeniceus), tordos canadienses (Euphagus carolinus) y zanates norteños (Quiscalus quiscula), ente que se rellacionaben con menor frecuencia con praderos orientales (Sturnella magna) y malvises pechirrojos (Turdus migratorius) nel este y tordos güeyu mariellu (Euphagus cyanocephalus) y tordos cabeciamarillos (Xanthocephalus xanthocephalus) nel oeste. Los xuveniles lleguen a les árees de reproducción dempués que los adultos. Bent afirmó que la migración serondiega empieza en setiembre, pero tien llugar principalmente n'ochobre, con dellos individuos quedando entá na so área de distribución braniza bien entráu payares.[17]
Anque los machos con pareya y les femes esvalixar nos sos territorios reproductivos, suelen atopase nes cercaníes bandaes d'individuos ensin pareya o promiscuos colos cualos les aves reproductives rellacionar hasta ciertu puntu. Herbert Friedmann (1929) nunca los documentó engarrando, pero la Sra. Nice (1937) ver reñer en cinco oportunidaes “n'ocasión de discrepancies ente los machos mientres eventos de cortexu comunal.”[17]
Asina remata la puesta de güevos, los tordos cabecicafé empiecen a arrexuntase en grandes bandaes p'alimentase nos campos y praos. Los mozos sumir a estos grupos cuando s'independicen de los sos padres adoptivos. Elon H. Eaton (1914) envaloró que la bandada promediu na seronda sería d'ente 50 y 200 aves.[17]
En dellos llugares —particularmente nel oeste—[20] los xuveniles pueden non interactuar en nengún momentu colos adultos mientres el so primer añu de vida, ente que n'otros sitios xunir a bandaes d'otros tordos cabecicafé mientres aquéllos entá s'atopen nos díes finales de la temporada reproductiva y permanecen al so llau mientres un añu enteru.[51] N'árees apocayá colonizaes, esiste una mayor fluidez social ente los individuos d'esta especie, esto ye, más exemplares sumir o se dixebren de les bandaes, ente qu'en poblaciones más antigües apréciase una mayor estabilidá social.[20] Rexistráronse bandaes puramente de xuveniles, namái de femes y mistes.[51]
Fora de la dómina de reproducción, duermen en compañía de delles especies d'ictéridos en grupos de más de 100 mil aves.[8] Los tordos sarxentu (Agelaius phoeniceus), zanates norteños (Quiscalus quiscula), tordos cabecicafé y estorninos pintos (Sturnus vulgaris) pasen la nueche en grandes concentraciones a finales del branu y na seronda.[53] En Kentucky, estes asociaciones mistes pueden superar los 5 millones d'individuos, de los cualos un 2 a un 5% son xeneralmente tordos cabecicafé.[3][8] En Oklahoma, les bandaes de descansu tienen la so puxanza en payares, con 250 a 900 mil aves.[3][5]
N'ocasiones, los tordos cabecicafé pasen la nueche acompañaos de golondrines.[17] Milton B. Trautman (1940) documentó que dellos tordos cabecicafé que pasaben l'iviernu en Ohio dacuando acomuñábense con gorriones comunes (Passer domesticus).[17] Mientres l'iviernu, ye posible velos al pie de tordos tricolores (Agelaius tricolor) nel delta de Sacramento-San Joaquín y la zona central de la mariña de California.[54] Edward Howe Forbush (1927), per otra parte, manifestó que “en Nueva Inglaterra los tordos cabeciafé xeneralmente duermen ente ellos; con frecuencia escueyen coníferes de tueru gruesu o otres arbolees nes que pasen la nueche en grandes númberos. Otru llugar de descansu predilectu ye ente la campera y los xuncos n'amplios praos.”[17]
John Y. Galley unviólu a Arthur Cleveland Bent les sos anotaciones con respectu'l so estudiu sobre una gran bandada iverniza de descansu de tordos cabecicafé y estorninos en Midland (Texas). Nel momentu de mayor bayura, envaloró que'l sitiu nel qu'estes aves folgaben arrexuntaría “ente 10.500 y 11.000 individuos, de los cualos 2.000 o 2.500 yeren tordos cabecicafé.” Dormíen en llameres chines (Ulmus parvifolia) alredor del palaciu de xusticia de la ciudá. “Los estorninos rexuntar nes cañes más altes, los tordos cabecicafé debaxo d'ellos.”[17]
Les vocalizaciones son el componente básicu del sistema de comunicación de los tordos cabecicafé.[51] Al igual que n'otros paseriformes, cumplen un rol importante mientres la dómina de reproducción.[55] Son utilizaes ente los machos no que podría denominase "duelos vocales" que sirven pa establecer xerarquíes de dominancia dientro d'un grupu.[51] Coles mesmes, cantar persistentemente ye-yos necesariu pa consiguir una compañera cola qu'apariase.[51] Magar tamién canten nos meses d'iviernu, los machos faen mayor usu d'estes vocalizaciones, fundamentales p'atraer a les femes, como parte del cortexu y mientres la temporada reproductiva.[55] Aretas A. Saunders describió:
Dalgunos de los soníos del tordu cabecicafé son claramente estacionales, emitíos na so mayoría, sinón puramente, pol machu y polo tanto tendríen de ser consideraos cantares, anque nun sían bien prestosos al escuchu. La más común d'elles consiste nuna nota enllargada, aguda y chillona, siguida d'otros dos o trés notes más curties y graves y xeneralmente sibilantes. Podría ser transcripta como wheeeee tsitsitsi. (…) La primer nota puede tar por completu dientro d'un mesmu tonu o alzase llixeramente. Una alternativa non inusual consiste nuna primer nota procedida por una variación descendente que ye esplosiva y sibilante de primeres; suena wheeeee tseeya y recuerda abondo a una tusida.
Mientres el cortexu, cuando'l machu ta inclinándose y esplegando les sos nales y cola, produz otru tipu de cantar, daqué similar a la descripta pal zanate so circunstancies asemeyaes, pero polo xeneral xube abruptamente dende un tonu acústicu grave a unu agudu: dos o trés notes baxes y depués unes poques altes y chillonas. Les notes graves nun son aspres, sinón gorgoteantes. Suena como glub-glub-kee-he-heek. (…)
El periodu nel qu'estos cantares son reproducíes estender ente l'apuerto de les aves y principios de xunetu, cuando termina la puesta de güevos y les aves rexuntar en bandaes p'alimentase nos campos mientres el restu del branu. Les notes de los sos llamaos inclúin un curtiu chuck, un preeah pocu definíu y un traqueteo fuerte y aspru.[17]
El botánicu y ornitólogu Eugene Pintard Bicknell (1884) afirmó:
Paez nun haber regularidá nel so cantar na seronda; pero escuché dellos cantares imperfectos o incompletes en distintes oportunidaes nel mes siguiente a mediaos de setiembre. Dacuando, na seronda, cuando los tordos cabecicafé rexuntar en pequeñes bandaes, vuélvense parladores y l'emisión combinada de les sos notes graves produz el soníu d'un garllo nidiu.[17]
La so dieta ta compuesta de granes, frutos, bayes, inseutos y otros invertebraos.[11] Prefieren les granes de yerbes a los granos de cultivu.[8] Mientres el branu, les granes representen alredor de la metá de la so dieta, ente que la otra metá consiste n'inseutos y otros invertebraos. Les granes y los granos residuales componen más del 90% de la so alimentación ivernizo.[31]
Aliméntense sobre'l suelu,[13] en grupos mistos d'ictéridos y estorníns.[8] Mientres caminen sobre la tierra alimentándose, llevanten la cola percima del so envés.[18][56] Frecuentemente siguen a caballos, vaques y bisontes p'atrapar los inseutos qu'éstos llevanten al caminar; d'ellí, los nomes de "vaqueru cabecicafé" y "vaqueru de cabeza castaña".[17] Busquen alimentu ente les cabeces y les pates del ganáu, ensin axorizase.[17] N'ocasiones tamién se posen sobre'l llombu d'estos mamíferos y estrayen les cachiparros ya inseutos qu'atopen sobre ellos. Dellos autores d'antaño afirmaron que buscaben viermes intestinales ente los escrementos de dichos animales; sicasí, según Arthur Cleveland Bent, esto nun foi sofitáu polos analises estomacales.[17] Les femes precisen grandes cantidaes de calciu pa depositar los sos numberosos güevos, que consiguen inxiriendo les conches de cascoxos y dacuando los pulgos de los güevos de l'ave hospedadora que'l so nial parasiten, particularmente mientres la temporada reproductiva.[8][31]
Beal (1900) escribió sobre los conteníos estomacales de 544 tordos cabecicafé, llograos de 20 distintos estaos mientres tolos meses del añu y esaminaos pola Biological Survey:
Los alimentos topaos nestos estómagos fueron clasificaos de la siguiente manera: materia animal (22,3%) y materia vexetal (77,7%). (...) Los alimentos d'orixe animal consisten casi dafechu n'inseutos y arañes, siendo unos pocos cascoxos la esceición. Los inseutos entienden aviespes y formigues (Hymenoptera), hemípteros, delles mosques (Diptera), escarabayos (Coleoptera), saltamontes (Orthoptera) y gates (Lepidoptera). (…) Los saltapraos paecen ser l'alimentu animal favoritu de los tordos cabecicafé y componen la metá de la so dieta insectívora o un 11% del total. (…) Los alimentos d'orixe vexetal del tordu cabecicafé entepasen a los d'orixe animal tantu en calidá como en variedá. Cuando esamina'l suelu en cascos d'estancia y caminos evidentemente busca granes espardíes más qu'inseutos, anque probablemente tomen estos postreros cuando los atopen.(…) [Consume tamién] granes dures de camperes y yerbes, con pocos nicios de consumu de magaya de fruta o otru tipu de materia vexetal nidiu.[17]
Atopáronse granos de maíz en 56 estómagos, de trigu en 20, d'avenes en 102 (…), ente que se toparon granes d'ambrosías en 176 estómagos, de Echinochloa[57] en 265 y de Panicum en 133. Los granos constituyíen un 16,5% —alredor d'un sestu— de la so dieta añal y probablemente la metá d'estos sían granos residuales.[17] Beal afirmó:
Resumiendo los resultaos de la investigación, los siguientes puntos pueden considerase abondo sólidos: 1) Un 20% del alimentu del tordu cabecicafé consiste n'inseutos, que son perxudiciales, o bien, cafiantes. 2) Un 16% ye granu, que'l so consumu podría considerase una perda, anque ye casi seguro que la metá d'ésti seya granu residual. 3) Más del 50% consiste en granes de yerbes perxudiciales, que la so eliminación ye beneficiosa pal productor. 4) Práuticamente nun comen fruta.[17]
B. H. Warren (1890) aseveró que los tordos cabecicafé peracaben mores, cereces monteses, Vitis aestivalis y otres bayes. Y. R. Kalmbach (1914) incluyir ente les aves que comen Hypera postica, un escarabayu curculiónido qu'afecta los cultivos d'alfalfa; según él, dende'l 1 de mayu hasta mediaos de xunetu, el curculionoideo constitúi más de la metá de la so ingesta. El zoólogu Arthur Holmes Howell (1907) afirmó que s'alimentaba del Anthonomus grandis, otru curculiónido nocivu pa l'agricultura, qu'estropia los cultivos d'algodón. Hervey Brackbill escribiólu lo siguiente a Arthur Cleveland Bent: “Una tarde atopé con una fema de tordu cabecicafé comiendo granes de diente de lleón direutamente de la estructura que les sostenía. Tuvo De haber atopáu dificultosu alimentase d'esi tarmu rectu, por que lo dempués de que guardara unos pocos taragaños sos, suxetar sobre'l suelu con una de les sos pates y terminó de comer d'esa manera.”[17]
La traza más carauterística d'esta ave con al respeutive de la so reproducción ye'l fechu de que practica'l parasitismu de puesta. La fema deposita les sos güevos nos nials d'otres aves —típicamente, paseriformes pequeños—,[1] en particular naquéllos en forma de taza.[22] Los machos algamen la maduror sexual al añu, pero escasamente apáriense hasta los dos años.[3][5] Les femes reprodúcense yá al añu d'edá.[3][5] Al igual que n'otros paseriformes, les vocalizaciones cumplen un rol importante mientres la dómina de reproducción. Magar tamién canten nos meses d'iviernu, los machos faen mayor usu d'estes vocalizaciones, fundamentales p'atraer a les femes, como parte del cortexu y mientres la temporada reproductiva.[55]
La temporada reproductiva empecipia n'abril, remata en mayu, empieza a tornar en xunu y sigue de manera esporádica en xunetu.[1] Según Ortega (1998), xeneralmente estiéndese dende empiezos de mayu a fines de xunetu, un periodu que se superpone cola dómina de reproducción de numberoses aves norteamericanes de los pacionales (Stewart, 1975).[33] En Dakota del Norte, acordies con Stewart (1975), enllargar hasta mediaos d'agostu, pero tien la so puxanza ente entamos de mayu y mediaos de xunetu.[33] En Connecticut, ye posible ver adultos cortexando en marzu y entamos d'abril y les femes empiecen a depositar los sos güevos a mediaos de mayu.[23] Según información de 1958, los tordos cabecicafé ponen los sos güevos en Maryland y el Distritu de Columbia dende fines d'abril a fines de xunetu (siendo les feches estremes el 24 d'abril y el 28 de xunetu), particularmente dende empiezos de mayu hasta empiezos de xunetu.[3][52] Según un estudiu publicáu en 1993, en Misuri atopáronse güevos d'esta especie en niales ayenos dende mediaos d'abril hasta mediaos de xunetu.[3][5]
Numberosos estudios constataron una ciertu enclín a tornar una y otra vez a les mesmes zones de reproducción tantu per parte de los machos como de les femes. En Manitoba (Canadá), el 64% de 337 machos marcaos y el 46% de 173 femes marcaes esibíen un comportamientu de fidelidá escontra los sitios nos que se reproducíen (Woolfenden y otros, 2001). Shake y Mattsson (1975) atopar con qu'el 40% de 119 machos y el 9% de 81 femes marcaos en Michigan centroseptentrional tornaron a un radiu de 4,8 km dende'l puntu nel que fueren identificaos l'añu anterior. Nun estudiu lleváu a cabu en Illinois, Raim (2000) afayó qu'el 47% de 79 sitios de reproducción utilizaos por femes con marques de colores en xunu d'un añu volvía ser usáu poles mesmes aves al añu siguiente.[33]
Nel nordés d'Arkansas, afayáronse egagrópiles de búho campestre (Asio flammeus) que conteníen restos de tordos cabecicafé.[3][58] Los predadores de los pitucos inclúin la culiebra corredora constrictor (Coluber constictor), la víbora ratonera (Elaphe obsoleta) y el glayu azul (Cyanocitta cristata). Estes aves dacuando ataquen conxuntamente a los búhos cornudos (Bubo virginianus), un potencial predador tantu pa los adultos como pa los mozos. Los ectoparásitos, los helmintos y les bacteries infeicioses son otros factores de mortalidá.[3][5]
Acordies con Arthur Cleveland Bent (1958), mientres fuelguen son preses del visón americanu (Neovison vison), les papalbes (Mustela spp.) y los búhos, y mientres el día son atacaos por ferres (Falco spp.) y otros falconiformes. Harold S. Peters (1936) llista un pioyu, dos mosques, una cachiparru y otros dos especies d'ácaros como ectoparásitos del tordu cabecicafé oriental.[17]
Los químicos utilizaos pa controlar los inseutos pueden matar a los tordos cabecicafé. En Nuevu Méxicu, el toxafeno aplicáu a una superficie de 71.600 hectárees de pradería de campera curtia causó un amenorgamientu nel númberu d'estes aves (McEwen y otros, 1972). El diazinón alboráu sobre'l verde y sobre una cancha de baseball en Connecticut mató a docenes de tordos cabecicafé (Anderson y Glowa, 1985).[33]
Acordies con Arthur Cleveland Bent, los sos vezos alimenticios son decididamente más beneficiosos que perjudicales, provocando bien pocu dañu a los cultivos y esaniciando munchos inseutos nocivos. Aliméntense, por casu, de Anthonomus grandis y Hypera postica, dos especies de curculiónidos qu'afecten el algodón y l'alfalfa respeutivamente. La principal causa de la so impopularidá xaz nel dañu que produz al traviés del so comportamientu parasítico, que de xuru interfier cola crianza d'una gran cantidá de pequeñes aves insectívores.[17] Beal (1900) escribió al respeutu:
Cuando un únicu pitucu de tordu cabecicafé reemplaza una niarada de cuatro aves, produzse, obviamente, una perda clara; pero, como yá se dixo, tien d'atribuyíse-y una gran importancia económica por cuenta de los sos vezos alimenticios, y hai que recordar que na mayoría de los casos les aves esaniciaes son muncho más pequeñes que l'intrusu y polo tanto l'efeutu de la so alimentación ye menor, y que de cutiu se depositen dos o tres güevos de tordu cabecicafé nun mesmu nial.[17]
De 215 especies neotropicales migratories, Rodenhouse y otros (1992) listan al tordu cabecicafé ente les menos de diez que causen un dañu significativu a los cultivos sobre amplies árees xeográfiques.[59]
El problema del parasitismu del tordu cabecicafé, especialmente nos hábitats riberanos, foi documentáu.[21] Por cuenta de que puede tener un impautu significativu sobre l'ésitu reproductivu d'otres aves, munches aprendieron a reconocer esti peligru y actúen agresivamente escontra'l tordu cabecicafé cuando ésti avérase a los sos territorios.[13] La fragmentación de los montes en América del norte espandió'l so hábitat y amenorgó —y en munchos llugares, esanició— los hábitats de vexetación trupa nos qu'esta especie nun enfusaba.[13] De resultes, un ciertu númberu d'aves del monte sufre una amenaza progresiva de parasitismu de puesta.[13][28] A diferencia de les moradores de les Grandes Llanures, estes nueves víctimes non evolucionaron conxuntamente col tordu cabecicafé y, por esta razón, nun cunten coles defenses naturales necesaries pa faer frente al so parasitismu y vuélvense desaxeradamente vulnerables en presencia d'estos parásitos de puesta.[16][28] responsabilizóse-y pol amenorgamientu nes poblaciones de dellos paseriformes.[1] Per otru llau, Martin (1992) sostuvo que na mayoría de los llugares los efeutos de la depredación nos niales sobre la dinámica poblacional de los güéspedes del tordu cabecicafé superen llargamente les repercusiones del parasitismu de puesta.[14]
Anque delles especies pueden volver añerar y, poro, el so ésitu reproductivu nun se ve tan afeutáu pol parasitismu de puesta, otres aves que les sos temporaes de reproducción son más embrivíes nun son capaces de faelo y cuerren mayor riesgu pola mor del tordu cabecicafé. Sicasí, parte d'esti impautu ambiental ye controversial y un estudiu sobre la magnitú de los daños del tordu cabecicafé nes poblaciones d'aves norteamericanes argumentó que los conservacionistes y el públicu polo xeneral tienden a magnificar les implicaciones d'esta peculiar estratexa reproductiva como causa importante del decrecimiento de les poblaciones d'aves.[1]
Polo xeneral, les poblaciones de güéspedes tienen de producir 2,0 – 2,5 moces al añu por pareya pa caltener una tasa de crecedera poblacional positiva, asumiendo que la supervivencia añal seya d'un 40 – 60% pa los adultos y 20 – 35% pa los mozos. Los niveles de parasitismu de puesta que pueden ser toleraos calteniendo una crecedera poblacional positivu varien ente les distintes aves hospedadoras. Les especies con altos niveles de depredación nos sos niales, una baxa proporción d'abandonu de los niales parasitados, periodos d'incubación enllargaos y temporaes reproductives curties en rellación al periodu d'incubación namái pueden soportar una frecuencia parasítica menor. Contrariamente, les especies con escasa depredación nos sos niales, un altu porcentaxe d'abandonu de los niales frayaos —por casu: el verdín de les praderíes (Dendroica discolor); Nolan, 1978—, periodos d'incubación amenorgaos y dómines de cría más llargues podríen ser más resistentes a l'amenaza del parasitismu.[14]
El parasitismu de puesta del tordu cabecicafé representa efeutivamente una amenaza pa diversos paseriformes neotropicales Migración de les aves migratorios con árees de distribución acutaes.[14] Robinson y otros (1989) inclúin ente les aves amenaciaes pol parasitismu al chipe de Kirtland (Dendroica kirtlandii; Walkinshaw, 1983), una subespecie de víreo de Bell (Vireo bellii pusillus; Franzreb, 1989), otra de mosquerito saucero (Empidonax traillii extimus; Unitt, 1987; Brown, 1988), al víreo gorra negra (Vireo atricapilla; Grzybowski y otros, 1986) y al chipe mexelles doraes (Dendroica chrysoparia).[14] Cabo destacar que pal mosquerito saucero, según pa la mayoría de les especies en peligru afeutaes pol parasitismu del tordu cabecicafé, esiste una interaición complexa ente los efeutos direutos resultantes de la perda del so hábitat y los efeutos indirectos derivaos del parasitismu de puesta.[3][29]
Les pequeñes poblaciones d'estes aves son frecuentemente parasitadas, lo que condució a la implementación de programes de captura de tordos cabecicafé n'árees específiques de reproducción onde otres especies tán amenaciaes.[13] Los güéspedes con árees de distribución más amplies son menos vulnerables por cuenta de que les poblaciones severamente parasitadas pueden ser reestablecidas con inmigrantes procedentes d'otres rexones onde'l parasitismu seya menor.[14]
Nuna investigación llevada a cabu nel Sierra National Forest (California) ente 1980 y 1981 (Verner y Ritter, 1983), la bayura relativa de vírevos gorjeadores (Vireo gilvus) taba negativamente rellacionada cola de tordos cabecicafé, lo cual sofita los resultaos d'estudios anteriores qu'habíen atopáu altes tases de parasitismu de puesta nos niales d'esta especie na Sierra Nevada. Sicasí, por cuenta de que los tordos cabecicafé son raros o s'atopen ausentes en munchos de los principales tipos de hábitats y n'árees alloñaes de fontes d'alimentu venceyaes a les actividaes humanes, Verner y Ritter punxeron en dulda la posibilidá de que dalguna otra especie na Sierra Nevada viérase amenazada pol parasitismu. Aun así, el autores destacaron la necesidá d'un monitoreo periódicu por cuenta de la creciente presencia humana nos montes.[30]
Gaines (1974), nun estudiu de l'avifauna riberana del Valle de Sacramento (California), suxurió que los tordos cabecicafé constituyeren un factor relevante nos significativos amenorgamientos poblacionales de delles especies de paseriformes nesi llugar mientres los cuarenta años anteriores. El víreo de Bell (Vireo bellii) sumió aparentemente de California central y el parasitismu del tordu cabecicafé ye consideráu una de les principales causes d'esto (Games, 1974; Goldwasser y otros, 1980).[30]
Mayfield (1960) identificó una tasa de parasitismu del 55% nos niales del chipe de Kirtland (Dendroica kirtlandii).[60] En 1971, el mesmu autor agoró la estinción de la especie pa 1980 si'l tordu cabecicafé nun yera controláu.[61][62] Gracies a un programa estensivu empecipiáu en 1972, la población d'esta ave caltúvose estable mientres unos venti años anque ensin recuperase, hasta que se rexistraron llixeros aumentos poblacionales en 1991 y 1992.[62] Conforme a dos estudios de 1993, ye probable que dichu programa fuera la clave pa la estabilización de les poblaciones del chipe de Kirtland.[14][62]
En 1972, el Serviciu de Pesca y Vida Montesa de los Estaos Xuníos, en cooperación col Serviciu Forestal, el Departamentu de Recursos Naturales de Michigan y la Michigan Audubon Society, empezó a controlar el númberu de tordos cabecicafé con trampes allugaes nes árees de nidificación del chipe de Kirtland en primavera y a empiezos del branu. Les trampes, que conteníen miyu, agua y dellos tordos cabecicafé vivos, yeren revisaes a diariu y los tordos cabecicafé prindaos yeren esaniciaos. L'ésitu reproductivu del chipe ameyoró dramáticamente dende l'entamu del programa y la tasa de parasitismu amenorgar d'un 69% en 1966 - 1971 a menos del 5%. La cantidá de pitucos de chipe por nial que llograben independizase aumentó de menos d'unu a casi trés.[15][63]
El víreo de Bell (Vireo bellii) constrúi niales en forma de taza abierta, que son bien susceptibles al parasitismu del tordu cabecicafé (Goldwasser y otros, 1980). La reaición del víreo puede ser tantu l'abandonu del nial como l'aceptación de los güevos estraños (Barlow, 1962). Naturalmente, los niales non parasitados son más esitosos. Laymon (1987) calculó les curves de crecedera poblacional acordies con cuatro tases parasíticas distintos utilizando información d'ocho estudios ente 1929 y 1980: 13%, la tasa más baxa conocida; 30%, el promediu de los trés tases más baxes; 48%, el promediu de los ocho estudios, y 69%, el promediu de los dos tases más altes. Con una tasa de parasitismu d'un 13%, una población de vírevos de Bell de 10 femes algamaría les 100 femes en 6 años. Una población con una tasa de parasitismu del 30% precisaría 37 años pa llegar a les 100 femes, ente que tases del 48% y 69% llevaríen a la estinción en 18 y 8 años respeutivamente. Asina, les tases cimeres al 48% conduciríen a la estinción nun amenorgáu ralu de tiempu, ente que les mayores al 30% repercutiríen nuna población inestable que podría escastase por causa d'acontecimientos eventuales.[21]
La subespecie pusillus de víreo de Bell, otrora abondosu nel Valle Central de California y otros sistemes fluviales de baxa altitú n'esi estáu norteamericanu y nel mexicanu de Baxa California, sumió de la mayor parte de la so área de distribución reproductiva debíu al llindáu ésitu de la so reproducción pola mor del parasitismu del tordu cabecicafé y a la perda del so hábitat.[64] Amás d'en la so distribución, el Vireo bellii pusillus tamién sufrió un terrible amenorgamientu nel so númberu d'exemplares dende la década de 1920 por cuenta de la alteración de la vexetación riberana y al parasitismu de puesta.[65] Los programes de control d'estos parásitos de puesta n'árees riberanes resultaron beneficiosos pa la so reproducción.[64]
Na Columbia Británica, les especies que pueden tar amenaciaes pol parasitismu del tordu cabecicafé inclúin el mosquerito saucero (Empidonax traillii) y el víreo gorjeador (Vireo gilvus). El víreo, otrora común nel sur del valle d'Okanagan, práuticamente sumió del valle; el so amenorgamientu paez habese por cuenta de una combinación de la fragmentación del so hábitat y el parasitismu, factores que tán amenaciando la supervivencia d'otros paseriformes na rexón (Smith y otros, 1998).[27]
Pa dellos otros paseriformes, sicasí, particularmente les víctimes más frecuentes del parasitismu del tordu cabecicafé, que son especies comunes y llargamente distribuyíes, esiste poca evidencia de dalgún efeutu nocivu nes sos poblaciones. Por exemplu, nuna población de gorriones melódicos (Melospiza melodia) en Mandate Islland —una islla diminuta nel estrechu de Xeorxa, al sudeste de la isla de Vancouver—, les femes que los sos niales fueron parasitados siquier una vegada mientres la temporada reproductiva llograron criar tantos pitucos hasta qu'éstos llograren la independencia como les femes que nun sufrieren parasitismu dalgunu nos sos niales (Smith, 1981). La colonización de Mandate Islland per parte d'una o dos femes de tordu cabecicafé tuvo un impautu pequeñu nel númberu de gorriones melódicos por cuenta de la incompleta superposición de les temporaes de puesta de güevos de dambes especies, les multiplicidá de les niaraes del gorrión, la so habilidá pa criar a los sos propios pitucos al pie de los del tordu cabecicafé y el so ésitu reproductivu basáu na densidá de la so población (Smith y Arcese, 1994).[27][66]
A pesar de tar legalmente protexíu pol Migratory Bird Treaty Act,[3][67] los métodos de control direutu inclúin el envelenamientu, los disparos con armes de fueu y la captura con trampes.[33] Sicasí, les implicancias étiques de la erradicación de grandes númberos de tordos cabecicafé, una especie nativa, tienen de ser consideraes.[14] Ente los métodos de control indireutu atópense la preservación d'amplies superficies de monte,[68] la reforestación[21] y l'eliminación de les sos zones d'alimentación.[68]
Conocer n'ónde s'atopen les árees d'alimentación local ye esencial pa diseñar y predicir la efeutividá de los esfuercios por controlar el so númberu (Rothstein y otros, 1987). La telemetría aprove la meyor información sobre l'usu d'árees d'alimentación y de reproducción (Rothstein y otros, 1980 y 1984; F. Thompson, información ensin publicar), pero ye cara —alredor de 140 dólares por tresmisor— y trabayosa. F. Thompson envaloró que rastrexar a 35 o 40 femes con trasmisores con un equipu de trés persones mientres un periodu de dos meses costaría ente 25.000 y 35.000 dólares añales por sitiu estudiáu. Si la telemetría resulta demasiáu costosa, los tordos cabecicafé pueden ser censaos visitando potenciales sitios d'alimentación, especialmente al mediudía y a la tarde. Si les sos árees d'alimentación son amenorgaes, ye más probable que la captura con trampes seya efeutiva (Rothstein y otros, 1987). Esisten ciertos nicios de que les femes podríen folgar en xunto inclusive mientres la temporada reproductiva en dellos llugares (F. Thompson, información ensin publicar), lo que se traduciría en mayores oportunidaes pal control local.[14]
Una vegada que s'identificó la presencia de tordos cabecicafé nuna área, tienen de llevase a cabo estudio pa determinar la tasa parasítica nes especies más vulnerables. El porcentaxe de parasitismu puede ser envaloráu a partir d'una amuesa de niales (Pease y Grzybowski) o la frecuencia relativa cola que los güéspedes son vistos alimentando a los sos propios pitucos en comparanza a los pitucos de tordu cabecicafé. Si'l nivel de parasitismu ye alto —mayor al 25% de los niales—, ye probable que la especie nun refugue los güevos intrusos (Rothstein, 1975) y podría tar amenazada poles perturbaciones d'esta ave.[14]
Según Laymon (1987), los disparos posiblemente sían más efeutivos que les trampes en hábitats riberanos angostos. Mientres la temporada reproductiva, tantu los machos como les femes pueden ser atraíos a la área d'algame d'una arma utilizando grabaciones d'una fema (Rothstein, comunicación personal). El dispara-yos a les femes de manera selectiva dexando a los machos desbalancearía la so población. L'atraición de los tordos cabecicafé per mediu de llamaos grabaos saca provechu d'un comportamientu natural venceyáu a la so reproducción, razón pola cual ye improbable qu'esistan exemplares inmunes a esti métodu, un problema que sí puede surdir coles trampes.[21]
La otra téunica de control direutu frecuentemente utilizada consiste na so captura con trampes pel hibiernu en feedlots y tambos, o bien mientres la temporada reproductiva nes proximidaes de los niales de les especies amenaciaes. Les xaules de grandes dimensiones con tordos cabecicafé vivos nel so interior faciendo les vegaes de señuelos demostraron ser efeutives p'atrapar estes aves (Crase y otros, 1972). Los tordos cabecicafé son particularmente vulnerables a esti sistema por cuenta del so enclín a concentrase en bandaes numberoses mientres l'iviernu. Laymon (1987) suxure que la captura con trampes fora de la dómina de reproducción tien de considerase más seriamente nes árees con poblaciones comprobadamente sedentaries por cuenta de qu'en munchos casos desconoz si los tordos cabecicafé que pasen l'iviernu en ciertu llugar son los mesmos que se reproducen ellí; encamienta amás el marcáu de les aves pa estudiar los sos movimientos.[21]
En Arkansas, la 4-aminopiridina foi utilizada pa matar a les aves qu'estropiaben los cultivos, entemeciendo una parte d'esi químicu en nueve partes d'alimentu, lo que resultó na muerte de 5.400 tordos cabecicafé y estorninos pintos (Sturnus vulgaris; Dolbeer, 1988). Sicasí, la efeutividá de la 4-aminopiridina foi al curtiu plazu, por cuenta de que'l númberu d'aves recuperóse dientro de los 8 díes.[33]
L'empléu de trampes foi puestu en práutica exitosamente pa protexer delles especies neotropicales migratories con poblaciones pequeñes y árees de distribución locales.[14] Los tordos cabecicafé fueron viviegamente prindaos por axencies de recursos naturales nun esfuerciu por amenorgar el so impautu sobre les poblaciones de víreo gorra negra (Vireo atricapilla) en Texas y chipe de Kirtland (Dendroica kirtlandii) en Michigan.[23] Sicasí, ye pocu probable que la captura con trampes seya efeutiva sobre árees amplies tales como montes nacionales.[14]
Les dimensiones de les xaules suelen variar ente los 2 x 2,5 x 1,5 m y los 5 x 5 x 2 m. Les d'esti postreru tamañu son utilizaes más de cutiu pa desfacer de grandes cantidaes de ictéridos n'árees con una importante concentración mientres los meses d'iviernu. Pueden tar constituyíes por distintos paneles que se ensamblen y desarmen fácilmente si esiste la necesidá de treslladar les trampes. Los tordos cabecicafé son atraíos por señuelos —otros exemplares de la so especie vivos nel interior de les xaules— y comida ya ingresen al traviés d'una entrada en forma d'embudu o rendija. Les entraes en forma de rendija fueron, hasta ciertu puntu, más esitoses que los embudos no que se refier a evitar l'escape de les aves prindaes (D. Steed, comunicación personal). Les xaules más grandes resulten más eficientes que les de menor tamañu (Hesteberg y otros, 1985). Ye necesariu tener en cuenta l'anchu de l'abertures de la tela de gallineru utilizada na fabricación de les trampes: una pequeña variación nel so tamañu podría dexa-y a les femes, particularmente les de la subespecie más pequeña (M. a. obscurus), escapar.[14]
L'alimentu tien de ser allugáu direutamente debaxo de la entrada de la xaula pero non en montones grandes que puedan resultar estraños al tordu cabecicafé. Les trampes tienen de cuntar con oxetos sobre los que puedan posase y agua, preferentemente en puntos dende los cualos l'abertura d'entrada a la xaula nun seya direutamente visible. El suelu tien de tar llibre de verde y yerbes en tou momentu. Delles trampes col suelu raído en pacionales y terrenes agrícoles de cutiu atraen y prinden tordos cabecicafé n'ausencia de señuelos o inclusive nun habiendo un cebu adientro. Una variedá de granos y otres granes —incluyendo trigu, miyu, maíz molíu y xirasol— pueden funcionar como cebu.[14]
Los señuelos tienen de ser una combinación de machos y femes. La inclusión de siquier dos femes señuelo ente los machos aumenta sustancialmente la captura d'otres femes. Les proporciones desbalanceadas en favor de les femes ente les aves señuelo fueron les más eficientes p'atrapar exemplares d'esi sexu. La captura de femes optimizada per mediu de les femes señuelo compensa en demasía los escapes ocasionales de femes atrapaes que puedan parasitar niales d'especies sensibles. Al cortar les nales de les femes señuelo, pueden embrivise los escapes. Sicasí, les aves coles nales cortaes nun tienen de paecer feríes, cuidao que esto podría afectar la captura d'otros exemplares.[14]
Otra considerancia a tener en cuenta ye'l ralu de tiempu que les aves señuelo permanecen na xaula. Les que son calteníes mientres más de dos selmanes pueden alteriar la so comportamientu de tal manera qu'afectaríen negativamente la captura d'otros tordos cabecicafé. Esto asocede cuando los exemplares na trampa amuésense ansiosos por xunise a otros que s'averen. Por esta razón, los señuelos tienen de ser marcaos, removíos dacuando y reemplazaos con aves apocayá atrapaes.[14]
El campu d'aición de les trampes individuales nes árees de reproducción nun supera con frecuencia los 0,8 km a la redonda (Grzybowski, información ensin publicar). En Fort Hood (Texas), mientres 1991, asitiáronse 52 trampes pa protexer una población de víreo gorra negra (Vireo atricapilla) distribuyida en 152 territorios espardíos (Hayden y Tazik, información ensin publicar). Nes montes Wichita (Oklahoma), nueve trampes fueron usaes pa protexer aprosimao 75 territorios del víreo (Grzybowski, información ensin publicar). Sacantes que la población amenazada seya pequeña —y, poro, yá en serios problemes—, l'usu de trampes tendría de ser estendíu y en consecuencia costosu.[14]
L'allugamientu de les xaules puede xugar un rol d'importancia na captura de tordos cabecicafé. Les trampes tienen de ser asitiaes n'espacios parcialmente abiertos, cerca de potenciales puntos d'observación altos, pero non direutamente debaxo d'ellos. Collins y otros (1989) indicaron que les trampes allugaes en hábitats riberanos mestos yeren menos efeutives que les dexaes n'árees abiertes axacentes a dichos hábitats. Como regla xeneral, les xaules tienen d'asitiase de manera tal qu'un tordu cabecicafé folgando no fondero de la mesma nun pueda acolumbrar una caña o otru oxetu nel que posase al traviés de l'abertura d'entrada de la trampa.[14]
Los movimientos diarios del tordu cabecicafé podríen constituyir una de les considerancies más relevantes. Una bona estratexa d'allugamientu de les trampes consiste n'allugales ente los sitios d'alimentación y les árees que riquen proteición del parasitismu. Munchos tordos cabecicafé en terrenes apoderaos per llombes opten por travesar les per mediu de llechos secos de regueros, baxos y paso de monte al treslladase de les árees matutines de reproducción a les vespertines d'alimentación. Les xaules allugaes na entrada d'estes árees o nos pasos pueden ser más efeutives en dellos llugares. Nes montes Wichita, por casu, les trampes dexaes metanes les árees de cría del víreo gorra negra amenorgaron el parasitismu d'un 70% a un 30%, doblando o triplicando'l so ésitu reproductivu. Sicasí, cuando les trampes yeren puestes nel perímetru de les árees de nidificación del víreo, el parasitismu amenorgar a menos del 20% y la fecundidá aumentaba ente seis y ocho veces (Grzybowski, 1990 a).[14]
Otra estratexa consiste n'asitiar les xaules nes proximidaes de les árees d'alimentación, especialmente onde se concentren los reses. La tasa de captura de femes al día por trampa al empiezu del so implementación yera arrolladoramente cimeru cerca del ganáu o de bisontes americanos (Bison bison) que llueñe d'esos animales (Grzybowski, 1990 a). Sicasí, si'l ganáu alcuéntrase esvalixáu, la efeutividá d'esti métodu vese comprometida (Rothstein y otros, 1987; Tazik y Cornelius, información ensin publicar).[14]
Una variable pa esti últimu enfoque inclúi la rotación del ganáu. Na Kerr Wildlife Management Area (Texas), los reses yeren allugaes en pasturas darréu axacentes a les árees de cría del víreo gorra negra a empiezos de la temporada de nidificación. La tasa de captura de femes de tordu cabecicafé aumentó dramáticamente nes trampes más cercanes al ganáu, el nivel de parasitismu foi'l más baxu rexistráu y l'ésitu reproductivu, el más altu documentáu (Grzybowski, 1990 b).[14]
De cutiu, la tasa de captura ye alzada de primeres d'estos programes de control poblacional y baxa sustancialmente tres un periodu de captura inicial d'ente dos y cuatro selmanes. La mayor parte de los tordos cabecicafé son removíos nesi ralu inicial, anque les xaules dispuestes nes proximidaes de los sitios d'alimentación siguen atrapando tordos cabecicafé mientres la mayor parte de la temporada.[14]
Los disparos fueron implementaos al pie de les trampes en Fort Hood (Hayden y Tazik, información ensin publicar), pero los efeutos específicos de los mesmos nun taben aisllaos de los de la captura con xaules. Alredor de 247 femes fueron aniquilaes d'esta manera, dalgunes de les cualos probablemente seríen atrapaes de nun recibir un disparu. Sicasí, esta téunica puede ser utilizada pa desfacer d'un númberu significativu de tordos cabecicafé y pobablemente resulte útil y más efeutiva en delles árees con grupos pequeños o espardíos d'exemplares d'especies amenaciaes. Sicasí, los tordos cabecicafé son sensibles a l'actividá cerca de les trampes, incluyendo una enllargada presencia humana. Por esa razón, l'empléu d'armes como métodu de control poblacional nun tendría de ser efeutuáu nos sitios nos que s'allugaron trampes.[14]
Por cuenta de que los tordos cabecicafé fuelguen en grandes grupos fora de la temporada de reproducción, son potencialmente vulnerables a los esfuercios a gran escala por controlar el so númberu (Johnson y otros, 1980). Aparentemente, los programes previos de erradicación surtieron poco efeutu sobre la población nacional de tordos cabecicafé, posiblemente por causa de que les aves que se concentren nos mesmos puntos de descansu comunal proceden en realidá de munches rexones distintes. Arriendes d'ello, la efeutividá del control poblacional nesos sitios de descansu ye difusa, nun protexendo nenguna población amenazada en particular. Sicasí, el control poblacional nos puntos de descansu comunal pel hibiernu puede ser la manera más práutica d'amenorgar el so númberu n'hábitats estazaos nos que la captura con trampes a nivel llocal seya demasiáu costosa.[14]
Ente les soluciones alternatives, destáquense distintes téuniques destinaes a una xestión del hábitat qu'enzanque l'accesu a los niales de los güéspedes,[14][21] acute la disponibilidad d'alimentu,[21] mengüe la cantidá de hábitats fayadizos[14] y consecuentemente amenorgue les poblaciones de tordos cabecicafé y les repercusiones de la so peculiar estratexa reproductiva sobre les especies vulnerables.[14][21] L'amestadura de güevos artificiales o infértiles tamién demostró ser efeutiva pa disuadir el parasitismu.[33]
Robinson y otros (1995) suxuren, como estratexa rexonal a fin protexer les poblaciones de paseriformes migratorios nel Mediu Oeste, caltener y restaurar los vastos segmentos de montes que constituyan más probablemente fontes d'individuos qu'ayuden a estabilizar los sos númberos n'árees seriamente afeutaes pol parasitismu; coles mesmes, aconseyen embrivir los sos hábitats d'alimentación dientro de grandes estensiones ininterrumpíes.[68] Laymon (1987) encamentó evitar el llendo cerca de les árees riberanes, la eliminación de los feedlots, establos y tambos de les zones crítiques y la reforestación.[21]
Les poblaciones de tordos cabecicafé y les de munchu depredadores de niales son mayores n'árees estazaes onde se combinen hábitats d'alimentación (agrícoles y suburbanos) y de reproducción (montes y pacionales).[68] N'árees estazaes pelos terrenes agrícoles, los niveles de depredación nos niales y parasitismu de puesta son más tan elevaos que l'ésitu reproductivu de munches poblaciones locales de paseriformes del monte resulta insuficiente pa compensar la mortalidá n'individuos adultos.[68] A midida que los hábitats vense crecientemente estazaos, esta disfunción reproductiva puede causar decrecimientos rexonales nes poblaciones d'especies migratories.[68] Robinson y otros (1993) suxurieron qu'una xestión del hábitat qu'amenorgue tantu les poblaciones de tordos cabecicafé como les de los depredadores de niales podría constituyir la meyor solución al llargu plazu pa caltener les poblaciones de les especies migratories neotropicales; la xestión del hábitat resulta efeutiva a una escala enforma mayor que la captura con trampes.[14]
En teoría, les aves qu'añeren nos angostos corredores riberanos son más susceptibles al parasitismu de puesta qu'aquélles que nidifican en hábitats más amplios.[21] Esto debe a que la vexetación de los mesmos sueli ser llinial, dexando poca superficie inaccesible pa los tordos cabecicafé, contrariu a lo qu'asocede con espesures en forma de círculu o cuadráu.[3][69] Por esta razón, ye posible que la tasa de parasitismu pueda amenorgase al aumentar l'anchor de dichos corredores al traviés de la reforestación.[21]
Laymon (1987) suxure que la reforestación ye'l métodu más promisorio al llargu plazu pa controlar el parasitismu de puesta del tordu cabecicafé. Constitúi una solución permanente al problema y nun riquir mano d'obra o financiamiento continuos. Coles mesmes, los programes de tales carauterístiques beneficien a toles especies d'aves nes comunidaes riberanes, non yá a la que pretenda protexese de manera particular del parasitismu de puesta.[21]
Por cuenta de que los tordos cabecicafé atópense frecuentemente en terrenes agrícoles, asentamientos humanos y marxes de hábitats, la meyor estratexa de xestión ye caltener amplies árees ininterrumpíes d'un mesmu hábitat. Desafortunadamente, les variaciones nel edge effect (“efeutu de cantu”) ente distintos llugares y l'enclín del tordu cabecicafé a treslladase llargues distancies na so busca de niales enzanquen la xera de determinar la superficie mínima d'hábitat continuu necesaria pa llindar l'impautu del so parasitismu. Como regla xeneral, sicasí, los segmentos grandes son preferibles a los amenorgaos, les franxes riberanes anches son meyores que les estreches y les formes compactes son menos aparentes pal parasitismu que les complexes con muncho marxe en comparanza a la área cubierta.[14]
Tamién tienen de tenese en cuenta les carauterístiques de la contorna de la área xestionada. Los qu'ufierten escases oportunidaes d'alimentación bien podríen nun tener problemes col parasitismu inclusive a lo llargo de marxes o pequeños claros. Sicasí, si contienen abondosos hábitats alimenticios, les poblaciones de tordos cabecicafé pueden encher los hábitats reproductivos ensin importar la so proximidá a los marxes.[14]
Les estimaciones de la superficie mínima de monte continuu que se riquir pa caltener les poblaciones de les especies migratories neotropicales varien según la rexón. Robbins y otros (1989) encamentaron la preservación de siquier 3 mil hectárees allegantes con cuenta de protexer les poblaciones locales de paseriformes del monte nos estaos del Atlánticu mediu. La información sobre árees moderadamente estazaes nel Mediu Oeste suxure qu'una superficie cubierta d'ente 20 mil y 50 mil hectárees podría ser necesaria una y bones la bayura de tordos cabecicafé nesa rexón ye bien alta y les tases de parasitismu siguen siendo alzaes inclusive a dos kilómetros de los sitios d'alimentación. El Biological Advisory Team (1990) del Plan de Caltenimientu d'Hábitat de Balcones Canyonlands (Texas) determinó la necesidá d'establecer tramos d'ente 2 mil y 5 mil hectárees pa embrivir los efeutos del parasitismu y la depredación nos niales del chipe mexelles doraes (Dendroica chrysoparia).[14]
Robinson y otros (1993) encamentaron que la compra de tierres enfocar nel afitamientu de la propiedá de los segmentos d'hábitat más grandes dientro d'una rexón y na restauración de montes pa esaniciar les árees alimenticies de los tordos cabecicafé. Tamién sofiten la compra de tierres y la restauración de los corredores riberanos p'asegurar la esistencia de hábitats lo suficientemente anchos pa caltener les poblaciones del víreo de Bell (Vireo bellii) y el mosquerito saucero (Empidonax traillii). L'afitamientu de la propiedá de grandes segmentos ye particularmente gustante a ser efeutiva en hábitats moderadamente estazaos, onde les superficies cubiertes de mayor tamañu representaríen fontes potenciales d'inmigrantes que recolonizarían los fragmentos más pequeños.[14]
Tienen De evitase los proyeutos de planificación suburbana y agrícola qu'impliquen l'aislamientu de pequeñes porciones de monte y favorezan una medría nel númberu de tordos cabecicafé. El planiamientu tien de realizase de manera tal que caltenga los espacios montiegos con formes compactes en llugar d'aquéllos llargos y angostos.[14]
Dientro de los segmentos más amplios d'un hábitat, tien d'evitase cualquier práutica qu'aumente les oportunidaes alimentarias del tordu cabecicafé como cortar el verde a les bandes de los caminos y en cámpings, asitiar comederos p'aves, construyir corrolades y utilizar el terrén como pasturas pa los animales. Si esto nun ye vidable o prácticu, los potenciales sitios d'alimentación tendríen de tar tan concentraos como fuera posible y sería aconseyable la implementación de programes de captura con trampes. Inclusive si les tases de parasitismu del tordu cabecicafé son baxes nestos segmentos grandes, l'amenorgamientu del ésitu reproductivu cerca de les árees d'alimentación podría amenorgar sustancialmente la disponibilidad d'exemplares de les especies migratories neotropicales que recolonicen otros más pequeños.[14]
En llugares severamente estazaos onde la compra de tierres y la restauración del hábitat nun son vidables y/o práutiques, la captura en puntos estratéxicos podría ser la única manera de caltener les poblaciones restantes d'especies sensibles. Dicha captura, sicasí, probablemente resulte costosa por cuenta de la disponibilidad de tantos sitios d'alimentación. Nestos hábitats, cuando ye implementada nes árees de reproducción, la captura con trampes podría ser más efeutiva que nes d'alimentación.[14]
N'árees montiegues aprovechaes na industria maderero, los métodos de balta tienen de variar dependiendo de les caractrísticas del hábitat. N'estenses superficies arbolaes, como la pandu de Ozark en Misuri, Thompson y otros (1992) afayaron que los tordos cabecicafé preferíen marxes valtaos, pero en términos xenerales nun yeren más abondosos en presencia o ausencia d'ellos. Nestos llugares, la téunica de balta utilizada probablemente tenga un impautu menor nos niveles de parasitismu de puesta por cuenta de que, de toes formes, les sos poblaciones tán llindaes pola disponibilidad de los hábitats d'alimentación. De manera similar, en montes severamente estazaos con abondosos hábitats d'alimentación, los tordos cabecicafé podríen encher l'hábitat reproductivu ensin importar el métodu de balta implementáu.[14]
Sicasí, probablemente ésti nun sía'l casu en montes moderadamente estazaos, onde l'apertura d'escamplaes na canopea ufierta al tordu cabecicafé nueves oportunidaes d'averase a los niales hospedadores. Baltar de superficies d'ente 0,1 y 1 hectárees tien el potencial d'amontar la frecuencia parasítica por cuenta de qu'aumenta el marxe del hábitat. La información arrexuntada nun monte estazáu nel sur d'Illinois (Robinson, información ensin publicar) amosaba tases más altes de parasitismu en delles especies, anque non en toes, en porciones nes que s'habíen alloriáu baltando pequeños grupos d'árboles mientres los últimos cinco años.[14]
La franxa d'árboles que n'ocasiones se balta a lo llargo de los caminos tien de ser tan angosta como seya posible y tien de cubrir con nueva vexetación pa evitar el surdimientu d'un hábitat aparente pa l'alimentación del tordu cabecicafé.[14]
Acordies con Robinson y otros (1993), tienen de caltenese y restaurase amplies superficies allegantes de praderíes de campera alta. La compra de tierres tendría qu'enfocase n'embrivir la fragmentación y los hábitats alimentarios del tordu cabecicafé. Al igual que colos montes, ye importante evitar los proyeutos de planificación suburbana y agrícola qu'impliquen l'aislamientu de pequeñes porciones de pradería. De nun ser esto posible, el planiamientu tien de procurar la preservación de formes compactes. Sacantes que constituyan un puntu críticu d'hábitat reproductivu pa les especies vulnerables, ye aconseyable que los árboles secos de pies y el corredores dientro de les praderíes o axacentes a elles sían esaniciaos.[14]
Un usu menor o nulu de les praderíes alpines pa l'alimentación del ganáu ameyora l'ésitu reproductivu de les especies riberanes sensibles, tales como'l mosquerito saucero (Empidonax traillii).[21][70] L'ausencia del ganáu dexaría una mayor crecedera nel verde, que algamaría un altor cimeru a la fayadiza pa los vezos alimenticios del tordu cabecicafé.[21] De la mesma, esto daría llugar a hábitats riberanos más trupos nos que los niales seríen más difíciles d'atopar.[21] La reubicación de los feedlots, establos y tambos llueñe de los montes riberanos amenorgaría los hábitats d'alimentación del parásitu cercanos a les árees de nidificación de les especies amenaciaes.[21]
Robinson y otros (1993) suxuren que los feedlots sían diseñaos de manera tal que'l volume de granu residual mengüe. La rotación del ganáu amenorga la superficie cubierta por verde curtiu, lo cual de la mesma podría tener un efeutu importante nel tamañu de les poblaciones locales de tordos cabecicafé. Por cuenta de que una mayor disponibilidad de granu residual pel hibiernu podría tar aumentando la tasa de supervivencia del parásitu (Brittingham y Temple, 1983), métodos de collecha más eficientes podríen amenorgar la cantidá d'exemplares. Sicasí, una disponibilidad menor d'esta fonte d'alimentu, tamién podría repercutir sobre les poblaciones de gansos y otres Carne de caza preses de caza, lo cual podría aniciar un conflictu.[14]
Otra téunica destinada a amenorgar el parasitismu del tordu cabecicafé implica asitiar güevos artificiales o infértiles dientro de los niales (Ortega y otros, 1994). L'amestadura d'estos güevos en niales de tordu sarxentu (Agelaius phoeniceus) disuadió el parasitismu nesos niales. Per otru llau, la remoción de güevos depositaos de manera natural pue ser inefectiva por cuenta de qu'otres femes creeríen que los niales nun fueron parasitados y pondríen los sos güevos nellos.[33]
 Esta páxina forma parte del wikiproyeutu Aves, un esfuerciu collaborativu col fin d'ameyorar y organizar tolos conteníos rellacionaos con esti tema. Visita la páxina d'alderique del proyeutu pa collaborar y facer entrugues o suxerencies.
Esta páxina forma parte del wikiproyeutu Aves, un esfuerciu collaborativu col fin d'ameyorar y organizar tolos conteníos rellacionaos con esti tema. Visita la páxina d'alderique del proyeutu pa collaborar y facer entrugues o suxerencies. Molothrus ater tamién conocíu como tordu negru, tordu negru común, tordu cabeza marrón, tordu cabeza café, tordu cuquiellu, vaqueru cabecicafé, vaqueru de cabeza castaña o boyero negru, ye un ave de vezos parcialmente migratorios perteneciente a la familia de los ictéridos, dientro del orde de los paseriformes. Habita en rexones de clima templáu y subtropical d'América del Norte. Ye sedentariu nes rexones australes de la so área de distribución; les aves del norte, sicasí, migren al sur de los Estaos Xuníos y a Méxicu en iviernu y tornen al so hábitat de branu en marzu o abril. Trátase d'una especie abondosa y llargamente distribuyida, de comportamientu gregariu, que s'alimenta fundamentalmente de granes y artrópodos.
Esibe un marcáu dimorfismu sexual, y ye conocíu por ser el parásitu de puesta más común d'América del norte, depositando los sos güevos en nials de más de 220 especies d'aves, amenorgando l'ésitu reproductivu y amenaciando la supervivencia de delles d'elles. A pesar de compartir esta particular estratexa reproductiva con munches especies de cucos, nun ta emparentáu con ellos, sinón que se trata d'un casu de converxencia evolutiva.
Enantes del asentamientu européu, el tordu cabecicafé siguía les menaes de bisontes (Bison bison) al traviés de les Grandes Llanures, y quiciabes tamién al antílope americanu (Antilocapra americana) y al uapití (Cervus canadensis). El parasitismu de puesta complementaba esti estilu de vida nómade. El so númberu creció cola creación de nuevos hábitats abiertos per parte de los colonizadores. Invadió los estaos a veres de los Grandes Llagos y el nordés d'Estaos Xuníos mientres el sieglu XIX. Tamién se tremó escontra l'oeste, llegando a California. Na actualidá, ye posible velos alimentándose en comederos p'aves n'árees suburbanes.
La merla de cap bru[1] (Molothrus ater) és un ocell de la família dels ictèrids (Icteridae) que habita boscos i praderies de gran part d'Amèrica del Nord, al sud d'Alaska, oest i sud de Canadà, la major part dels Estats Units i Mèxic.
La merla de cap bru (Molothrus ater) és un ocell de la família dels ictèrids (Icteridae) que habita boscos i praderies de gran part d'Amèrica del Nord, al sud d'Alaska, oest i sud de Canadà, la major part dels Estats Units i Mèxic.
Aderyn a rhywogaeth o adar yw Aderyn gwartheg penfrown (sy'n enw gwrywaidd; enw lluosog: adar gwartheg penfrown) a adnabyddir hefyd gyda'i enw gwyddonol Molothrus ater; yr enw Saesneg arno yw Brown-headed cowbird. Mae'n perthyn i deulu'r Tresglod (Lladin: Icteridae) sydd yn urdd y Passeriformes.[1] Dyma aderyn sydd i'w gael yng ngwledydd Prydain, ond nid yng Nghymru.
Talfyrir yr enw Lladin yn aml yn M. ater, sef enw'r rhywogaeth.[2] Mae'r rhywogaeth hon i'w chanfod yng Ngogledd America.
Mae'r aderyn gwartheg penfrown yn perthyn i deulu'r Tresglod (Lladin: Icteridae). Dyma rai o aelodau eraill y teulu:
Rhestr Wicidata:
rhywogaeth enw tacson delwedd Casig Para Psarocolius bifasciatus Gregl y Gorllewin Quiscalus nigerAderyn a rhywogaeth o adar yw Aderyn gwartheg penfrown (sy'n enw gwrywaidd; enw lluosog: adar gwartheg penfrown) a adnabyddir hefyd gyda'i enw gwyddonol Molothrus ater; yr enw Saesneg arno yw Brown-headed cowbird. Mae'n perthyn i deulu'r Tresglod (Lladin: Icteridae) sydd yn urdd y Passeriformes. Dyma aderyn sydd i'w gael yng ngwledydd Prydain, ond nid yng Nghymru.
Talfyrir yr enw Lladin yn aml yn M. ater, sef enw'r rhywogaeth. Mae'r rhywogaeth hon i'w chanfod yng Ngogledd America.
Vlhovec hnědohlavý (Molothrus ater) je malý druh pěvce z čeledi vlhovcovitých (Icteridae). Vyskytuje se v otevřených lesích a v blízkosti lidských obydlí v mírných a subtropických částech Severní Ameriky. Jižní populace jsou stálé, severní však na zimu migrují na jih Spojených států a do Mexika, odkud se zpět na hnízdiště navrací během března až dubna.[2]
Dorůstá průměrně 19,5 cm,[3] samci jsou celí leskle černí s hnědou hlavou, samice jsou hnědošedé se světlejší spodinou těla. Živí se převážně semeny a hmyzem. Vlhovec hnědohlavý náleží mezi hnízdní parazity; samice klade vejce nejčastěji do hnízd malých pěvců, ale je zdokumentováno více jak 220 různých hostitelských druhů, mezi které patří např. i kolibříci nebo dravci.[4] Úspěšné vyvedení mláďat však bylo zaznamenáno pouze u 140 z nich.[5]
V tomto článku byl použit překlad textu z článku Brown-headed Cowbird na anglické Wikipedii.
Vlhovec hnědohlavý (Molothrus ater) je malý druh pěvce z čeledi vlhovcovitých (Icteridae). Vyskytuje se v otevřených lesích a v blízkosti lidských obydlí v mírných a subtropických částech Severní Ameriky. Jižní populace jsou stálé, severní však na zimu migrují na jih Spojených států a do Mexika, odkud se zpět na hnízdiště navrací během března až dubna.
Dorůstá průměrně 19,5 cm, samci jsou celí leskle černí s hnědou hlavou, samice jsou hnědošedé se světlejší spodinou těla. Živí se převážně semeny a hmyzem. Vlhovec hnědohlavý náleží mezi hnízdní parazity; samice klade vejce nejčastěji do hnízd malých pěvců, ale je zdokumentováno více jak 220 různých hostitelských druhů, mezi které patří např. i kolibříci nebo dravci. Úspěšné vyvedení mláďat však bylo zaznamenáno pouze u 140 z nich.
Der Braunkopf-Kuhstärling (Molothrus ater) ist ein Singvogel aus der Familie der Stärlinge. Er ist ein obligater Brutparasit, der in Nordamerika von der gemäßigten Klimazone bis in die Subtropen vorkommt. Er nutzt eine ungewöhnlich große Zahl an Wirtsvogelarten: Für 144 Singvögel ist nachgewiesen, dass sie erfolgreich Jungvögel des Braunkopf-Kuhstärlings groß gezogen haben.[1]
Ursprünglich waren Braunkopf-Kuhstärlinge in ihrer Verbreitung auf die von Bisons beweideten Prärieflächen begrenzt, da er auf offene Flächen zur Nahrungssuche angewiesen ist. Seit dem Beginn der Besiedlung des nordamerikanischen Kontinents durch europäische Siedler hat er sein Verbreitungsgebiet stark ausgedehnt und sein Bestand ist stark angestiegen.[2] Heute ist diese Art eine der am weitesten verbreiteten Vogelarten Nordamerikas. Er ist ein sehr häufiger Vogel, die Bestandszahlen sind jedoch seit den 1960er Jahren konstant geblieben.[1]
Braunkopf-Kuhstärlinge des nördlichen Verbreitungsgebietes ziehen im Winterhalbjahr in den Süden der Vereinigten Staaten und nach Mexiko. Sie kehren von März bis April in ihre Sommergebiete zurück.[3]
Der Vogel hat einen kurzen finkenähnlichen Schnabel und dunkle Augen. Das Männchen ist hauptsächlich glänzend schwarz gefärbt mit einem braunen Kopf. Das Weibchen ist grau gefärbt mit einer helleren Brust und einer fein gestrichelten Unterseite.
Der Braunkopf-Kuhstärling lebt in offenen und halboffenen Landschaften in den meisten Teilen Nordamerikas. Während die südlichen Populationen Standvögel sind, ziehen die nördlichen in die südlichen USA oder nach Mexiko. Er zieht in Scharen, manchmal gemeinsam mit dem Rotschulterstärling und dem Star. In den Überwinterungsgebieten hält er sich in Scharen auf, die zehntausende Vögel dieser Art umfassen können.[4]
Im Winter ist der Braunkopf-Kuhstärling außerdem ein häufiger Gast an Futterhäuschen.
Der Braunkopf-Kuhstärling sucht am Boden nach Insekten, die von Weidetieren angezogen oder aufgescheucht werden. Ähnlich wie beim eurasischen Kuckuck erlaubt es der Brutparasitismus dieser Art, dass Brutgebiete und Nahrungsgründe weit auseinanderliegen. Typisch ist, dass Braunkopf-Kuhstärlinge während der Brutzeit den Vormittag über allein oder in Paaren in den Gebieten verbringen, die eine hohe Dichte an Wirtsvögeln aufweisen. Am Nachmittag suchen sie dann ihre Nahrungsgründe auf. Geeignete Nahrungsgründe finden sie auf Agrarflächen und Weideland. Sie suchen aber auch Vorstädte auf, wo Rasenflächen ihnen Nahrung bieten.
Zwischen den Nahrungsgründen und den Brutgebieten liegt gewöhnlich nur eine Distanz von einem bis sieben Kilometer. Es gibt jedoch durchaus andere Extreme: So bietet eine einzige Pferdeweide in der kalifornischen Sierra Nevada Braunkopf-Kuhsterlingen ein geeignetes Nahrungsgebiet. Diese einzige Weide erlaubt es Braunkopf-Kuhstärlingen jedoch, Wirtsvögel in einem 154 Quadratkilometer großen Gebiet zu parasitieren.[5]
Der Braunkopf-Kuhstärling ist ein Brutparasit, der seine Eier in Nester anderer kleiner Singvögel, besonders in Schalennester, wie die des Goldwaldsängers, legt. Die jungen Braunkopf-Kuhstärlinge werden von den Gasteltern auf Kosten des eigenen Nachwuchses gefüttert.
Migrierende Braunkopf-Kuhstärlinge kehren in ihre Brutgebiete in der Zeit von Ende März bis Anfang Mai zurück. Auf ihrem Zug nach Richtung Norden sind sie häufig mit Rotschulterstärlingen und Purpur-Grackeln assoziiert. Der Zeitraum der Eiablage beginnt frühestens im April und endet gegen Juli. Zu diesem Zeitpunkt bilden die Braunkopf-Kuhsterlinge erneut große Schwärme, um dann in die Überwinterungsgebiete aufzubrechen.[4]
Grundsätzlich variieren die Größe und die Exklusivität des Brutareals, das ein Weibchen des Braunkopf-Kuhstärlings nutzt, mit der Bestandsdichte sowohl von Braunkopf-Kuhsterlingen als auch der der Wirtsvogel. Grundsätzlich konkurrieren Weibchen untereinander um Wirtsvogelnester während die Männchen um die Weibchen konkurrieren.[5]
Die Brutareale, die Weibchen besetzen und auch verteidigen, variieren stark. In der Sierra Nevada nutzt ein einzelnes Weibchen ein Brutareal von durchschnittlich 68 Hektar. Ein gleich schwerer Singvogel, der seine Jungvögel selbst großzieht, nutzt normalerweise ein Brutareal von einem bis drei Hektar.[5] Da ein einzelnes Weibchen ein solches großes Brutareal nicht erfolgreich verteidigen kann, überlappen sich solch große Brutareale normalerweise. In Regionen mit einer höheren Dichte an Wirtsvogelarten sind die Brutareale deutlich kleiner. In verschiedenen Studien wurden unterschiedliche Brutarealgrößen festgestellt. So betrugen die Brutareale im Staate New York zwischen 10 und 33 Hektar, während sie bei einer anderen Untersuchung in Ontario zwischen acht und zehn Hektar betrugen. Areale dieser Größe werden von dem Weibchen energisch verteidigt. Das Männchen, mit dem sie sich verpaart haben, verteidigt dieses Gebiet dagegen energisch gegen alle anderen Männchen.[5]
In Gebieten mit einer sehr hohen Dichte an Braunkopf-Kuhsterlingen fehlt die enge Bindung zwischen Weibchen und Männchen. Braunkopf-Kuhstärlinge verhalten sich in diesen Gebieten nicht länger monogam, sondern sowohl Weibchen als auch Männchen paaren sich mit mehreren Partnern.
Die Anzahl der Wirtsvogelarten ist sehr hoch: Insgesamt wurden Eier des Braunkopf-Kuhstärlings in den Nestern von 220 verschiedenen Arten gefunden. 144 Arten davon haben erfolgreich Jungvögel dieser Art großgezogen. Die meisten davon füttern ihre Jungvögel mit Wirbellosen, eine Ernährung, auf die auch die Nestlinge des Braunkopf-Kuhstärlings angewiesen sind.[1] Wirtsvogelarten reichen von nur 6 Gramm schweren Mückenfängern bis zu 100 Gramm schweren Lerchenstärlingen. Einige der Wirtsvogelarten entsprechen mit ihrem Körpergewicht von 40 bis 50 Gramm der des Braunkopf-Kuhstärlings. Die meisten jedoch sind kleiner. In der Summe umfassen die Wirtsvogelarten die Mehrzahl der nordamerikanischen Singvögel.[1]
Wie bei vielen anderen brutschmarotzenden Arten überwacht und beobachtet das Weibchen zunächst die Nester potentieller Wirtsvogelarten und wählt das Nest bevor sie das Ei darin ablegt. Das Weibchen sitzt dafür gelegentlich über längere Zeit in Sträuchern oder auf Bäumen und hält nach Nestbauaktivitäten Ausschau. Fehlen solche Ansitzwarten, läuft das Weibchen auf dem Boden und beobachtet von dort aus die Umgebung nach solchen Aktivitäten. In dichter Vegetation fliegt das Weibchen auch kurz auf und landet dann mit lautem Flügelschlagen auf Stängeln, um so potentielle Wirtsvogelarten dazu zu bringen, von ihren Nestern aufzufliegen.[6]
Die Eiablage erfolgt meist dann, wenn auch der Wirtsvogel ebenfalls dabei ist, sein Gelege zu vervollständigen. Ähnlich wie bei brutschmarotzenden Kuckucken zerstört das Weibchen Eier und verletzt oder tötet Jungvögel, wenn die Brutaktivitäten des Wirtsvogels bereits zu weit fortgeschritten sind. In der Regel folgt auf den Verlust eines solchen Geleges ein Zweitgelege durch den Wirtsvogel, was dem Braunkopf-Kuhstärling die Möglichkeit gibt, sein Ei zum richtigen Zeitpunkt in das Gelege zu legen.[6]
Verglichen mit brutschmarotzenden Arten wie den Kuckucken ist nicht nur die Zahl der Wirtsvogelarten beim Braunkopf-Kuhstärling außergewöhnlich hoch, sondern auch der Parasitierungsgrad. Dies ist darauf zurückzuführen, dass Braunkopf-Kuhstärlinge eine sehr viel höhere Bestandsdichte haben als es Kuckucke üblicherweise der Fall ist. In der Region der Great Plains, wo Braunkopf-Kuhstärlinge am zahlreichsten sind, liegt der Parasitierungsgrad bei zahlreichen Wirtsvogelarten zwischen 20 und 80 Prozent.[1] Populationen des Gold-Waldsängers in der Nähe des kanadischen Manitobasees beispielsweise wiesen über einen Zeitraum von 12 Jahren einen Parasitierungsgrad von 21 Prozent durch den Braunkopf-Kuhstärling auf. Bei Dickzissel, Heuschreckenammer und Lerchenstärling, die alle drei am Boden brüten, stellte man dagegen in einer in Kansas durchgeführten Studie einen Parasitierungsgrad von 70 Prozent fest. Andere Beispiele für Arten, die in Regionen mit einer hohen Bestandsdichte an Braunkopf-Kuhstärlingen brüten, haben beispielsweise einen Paratisierungsgrad von 24 Prozent beim Weißbauch-Phoebetyrann, 76 Prozent beim Rotschulterstärling, 52 Prozent bei der Schwirrammer und 69 Prozent beim Rotaugenvireo.[1]
Besonders hoch ist der Parasitierungsgrad, wo nur noch wenige fragmentierte Waldflächen von landwirtschaftlichen Weideland oder Anbauflächen umgeben ist. In diesen Regionen weist beispielsweise die Walddrossel einen Parasitierungsgrad von bis zu 100 Prozent auf.[4] Auch die Zahl der Eier, die sich im Nest der Walddrossel findet, ist in diesen Gebieten hoch: Häufig finden sich in diesen Nestern so viele Eier von Braunkopf-Kuhstärlingen wie von Walddrosseln, da mehrere dieser Brutschmarotzer ein Ei in diese Nester legen.[4] N. B. Davies weist darauf hin, dass die Gründe, warum in Regionen mit fragmentierten Waldflächen der Parasitierungsgrad besonders hoch ist, noch nicht vollständig verstanden ist: Eine Rolle spielt jedoch, dass die angrenzenden Agrarflächen dem Braunkopf-Kuhstärling zahlreiche Nahrungsgründe bieten und Übergänge zwischen zwei verschiedenen Lebensräumen für eine Reihe von Wirtsvogelarten attraktive Nestgelegenheiten bieten, so dass sich Braunkopf-Kuhstärlinge primär auf diese Übergänge konzentrieren, wenn sie nach geeigneten Wirtsnestern suchen. Schließlich können diese Übergänge dem Braunkopf-Kuhstärling auch mehr geeignete Deckung bieten, von der aus er Wirtsvögel beobachten kann.[4]
In Regionen, in denen der Braunkopf-Kuhstärling ein Zugvogel ist, haben Wirtsvogelarten die Chance, dass sie zumindest ihr erstes Gelege ohne Parasitisierung groß ziehen können. In einer Studie im Bundesstaat Washington konnte man zeigen, dass Purpurstärlinge, die mit ihrer Brut zu Beginn des Monats Mai begannen, nur einen Parasitierungsgrad von 7 Prozent aufwiesen. Bei Vertretern dieser Art, die danach mit der Brut begannen, stieg der Parasitierungsgrad dagegen auf 50 Prozent.[4]
Der Braunkopf-Kuhstärling kann bis zu 36 Eier im Jahr legen. Wenn die fremden Eier von den Gasteltern erkannt werden, reagieren diese auf verschiedene Weise. Die Katzendrossel pickt die Eier auf. Andere Vögel bauen ein neues Nest über das alte. Manchmal werden die geschlüpften Braunkopf-Kuhstärlinge aus dem Nest geworfen.
Untersuchungen von Jeffrey Hoover und Scott Robinson haben gezeigt, dass der Braunkopf-Kuhstärling in der Hälfte der Fälle die Nester des Zitronenwaldsängers zerstört, wenn er sich weigert, den fremden Nachwuchs aufzuziehen. Wenn sich der Zitronenwaldsänger zuvor erfolgreich gegen eine Eiablage der Brutschmarotzer im eigenen Nest gewehrt hatte, blieben die Nester komplett verschont.
Vor der europäischen Besiedelung war der Braunkopf-Kuhstärling östlich des Mississippis selten. Da hier Bisons selten waren oder gar nicht vorkamen, fehlten die weitläufigen offenen Flächen, die durch eine Beweidung durch Bisons entstanden und auf die der Braunkopf-Kuhsterling angewiesen ist. Ein Indiz, dass er den ersten Siedlern unbekannt ist, ist sein Fehlen in Carl von Linnés Systema Naturae aus dem Jahre 1758, wo zwar der Rotschulterstärling und die Purpur-Grackel als typische nordamerikanische Vögel aufgeführt wurden, der Braunkopf-Kuhstärling dagegen fehlte.[7]
Die starke Ausbreitung des Braunkopf-Kuhsterlings auf dem nordamerikanischen Kontinent begann im 18. Jahrhundert. Vorausgegangen war ihr ein allmähliches Erschließen des östlichen Teils Nordamerikas, bis die ersten Siedler die östlichsten Ausläufer der Great Plains erreichten. N. B. Davies spricht von „Korridoren“ kurzgrasigen Weidelands, die die ersten Landwirte mit ihren Schweinen, Rindern und Schafen schufen, über die der bislang auf die Great Plains beschränkte Braunkopf-Kuhstärling weiter nach Osten vordringen konnte, wo die bereits länger bestehende europäische Besiedelung zwischenzeitlich einen Lebensraum aus landwirtschaftlichen Anbauflächen, Viehweiden und fragmentierten Waldbeständen geschaffen hatte, der den Lebensraumanforderungen des Braunkopf-Kuhsterlings entsprach.[7] Bereits um 1790 war der Braunkopf-Kuhstärling in einzelnen besiedelten Regionen im Osten der USA häufig anzutreffen. Zu dem Zeitpunkt lebten etwa vier Millionen Siedler in Nordamerika, ein Teil des Landes wurde bereits in der 6. Generation landwirtschaftlich bestellt.[7]
Mit zunehmender Besiedelungsdichte und damit zunehmender Viehhaltung nahm auch der Bestand an Braunkopf-Kuhsterlingen zu. Gegen Ende des 19. Jahrhunderts war der Braunkopf-Kuhsterling im Osten Nordamerikas ein durchgängig häufiger Vogel. Es ist sehr wahrscheinlich, dass zu dem Zeitpunkt diese Art sehr hohe Reproduktionsraten hatte, so dass eine zunehmende Bestandsdichte die Vögel zwang, neue Verbreitungsgebiete zu erschließen.[7] Für das 20. Jahrhundert liegen genauere Daten über die Ausbreitung vor. So verschob sich im 20. Jahrhundert in Ontario, einer Provinz im Südosten Kanadas, die nördliche Verbreitungsgrenze der Art um 300 Kilometer weiter nach Norden. Nova Scotia wurde in den 1930er Jahren von dieser Art besiedelt und Neufundland in den 1950er Jahren. In Florida und Georgia trat der Braunkopf-Kuhstärling ab den 1950er Jahren auf, in den 1960er Jahren erschloss er sich auch Alabama als weiteres Verbreitungsgebiet.[7]
Im Westen Nordamerikas reichte das historische Verbreitungsgebiet des Braunkopf-Kuhstärlings bis an die Rocky Mountains. Im Südwesten kam er in Arizona entlang des Colorado Rivers vor und war möglicherweise bis nach Texas vertreten. Von dort aus verbreitete sich der Braunkopf-Kuhstärling ab dem Beginn des 20. Jahrhunderts in Kalifornien.[8] Die Verbreitung erfolgte sehr schnell: Im Jahre 1955 trat die Art erstmals in der kanadischen Provinz British Columbia auf. Insgesamt gelang es der Art, innerhalb weniger Jahrzehnte ihr Verbreitungsgebiet 1600 Kilometer weiter nach Norden auszudehnen. Erneut war der entscheidende Faktor eine zunehmende Ausdehnung von Agrarflächen und ein Fragmentieren des Waldbestandes in dieser Region. In Teilen der Region ist der Braunkopf-Kuhstärling heute einer der häufigsten Brutvögel.[8]
Der US-amerikanische Ornithologe Herbert Friedmann hat sich fast 70 Jahre lang mit dem Braunkopf-Kuhstärling auseinandergesetzt. Die Erkenntnisse über den Brutparasitismus dieser Art gehen auf ihn und seine Mitarbeiter zurück, die in umfangreichen Feldstudien die Wirtsvogelarten und den Bruterfolg untersucht haben.[1]
Der Braunkopf-Kuhstärling (Molothrus ater) ist ein Singvogel aus der Familie der Stärlinge. Er ist ein obligater Brutparasit, der in Nordamerika von der gemäßigten Klimazone bis in die Subtropen vorkommt. Er nutzt eine ungewöhnlich große Zahl an Wirtsvogelarten: Für 144 Singvögel ist nachgewiesen, dass sie erfolgreich Jungvögel des Braunkopf-Kuhstärlings groß gezogen haben.
Ursprünglich waren Braunkopf-Kuhstärlinge in ihrer Verbreitung auf die von Bisons beweideten Prärieflächen begrenzt, da er auf offene Flächen zur Nahrungssuche angewiesen ist. Seit dem Beginn der Besiedlung des nordamerikanischen Kontinents durch europäische Siedler hat er sein Verbreitungsgebiet stark ausgedehnt und sein Bestand ist stark angestiegen. Heute ist diese Art eine der am weitesten verbreiteten Vogelarten Nordamerikas. Er ist ein sehr häufiger Vogel, die Bestandszahlen sind jedoch seit den 1960er Jahren konstant geblieben.
Braunkopf-Kuhstärlinge des nördlichen Verbreitungsgebietes ziehen im Winterhalbjahr in den Süden der Vereinigten Staaten und nach Mexiko. Sie kehren von März bis April in ihre Sommergebiete zurück.
The brown-headed cowbird (Molothrus ater) is a small, obligate brood parasitic icterid native to temperate and subtropical North America. It is a permanent resident in the southern parts of its range; northern birds migrate to the southern United States and Mexico in winter, returning to their summer habitat around March or April.[2]
The brown-headed cowbird was described by the French polymath Georges-Louis Leclerc, Comte de Buffon in 1775 in his Histoire Naturelle des Oiseaux from a specimen collected in the Carolinas.[3] The bird was also illustrated in a hand-colored plate engraved by François-Nicolas Martinet in the Planches Enluminées D'Histoire Naturelle, which was produced under the supervision of Edme-Louis Daubenton to accompany Buffon's text.[4] Neither the plate caption nor Buffon's description included a scientific name, but in 1783, Dutch naturalist Pieter Boddaert coined the binomial name Oriolus ater in his catalogue of the Planches Enluminées.[5] The brown-headed cowbird is now placed in the genus Molothrus that was introduced by English naturalist William John Swainson in 1832 with the brown-headed cowbird as the type species.[6][7] The genus name combines the Ancient Greek mōlos meaning "struggle" or "battle" with thrōskō meaning "to sire" or "to impregnate". The specific name ater is Latin for "dull black".[8] The English name "cowbird", first recorded in 1839, refers to this species often being seen near cattle.[9]
Three subspecies are recognised:[7]
The brown-headed cowbird is typical for an icterid in general shape, but is distinguished by its finch-like head and beak and smaller size. The adult male is iridescent black in color with a brown head. The adult female is slightly smaller and is dull grey with a pale throat and very fine streaking on the underparts. Their total length is 16–22 cm (6.3–8.7 in) and the average wingspan is 36 cm (14 in).[10] Body mass can range from 30–60 g (1.1–2.1 oz), with females averaging 38.8 g (1.37 oz) against the males' average of 49 g (1.7 oz).[11]
The species lives in open or semiopen country, and often travels in flocks, sometimes mixed with red-winged blackbirds (particularly in spring) and bobolinks (particularly in fall), as well as common grackles or European starlings.[2] These birds forage on the ground, often following grazing animals such as horses and cattle to catch insects stirred up by the larger animals. They mainly eat seeds and insects.
Before European settlement, brown-headed cowbirds followed bison herds across the prairies. Their population expanded with the clearing of forested areas and the introduction of new grazing animals by settlers across North America. They are now commonly seen at suburban birdfeeders.
In 2012, brown-headed cowbirds in northwest Riverside County, CA tested positive for West Nile Virus.[12]

The brown-headed cowbird is an obligate brood parasite; it lays its eggs in the nests of other small passerines (perching birds), particularly those that build cup-like nests. The brown-headed cowbird eggs have been documented in nests of at least 220 host species, including hummingbirds and raptors.[13][14] More than 140 different species of birds are known to have raised young cowbirds.[15] The young cowbird is fed by the host parents at the expense of their own young. Brown-headed cowbird females can lay up to 36 eggs in a season.
Some host species, such as the house finch, feed their young a vegetarian diet. This is unsuitable for young brown-headed cowbirds, meaning few survive to fledge.[16] Accepting a cowbird egg and rearing a cowbird chick can be costly to a host species. In the American redstart, nests parasitized by cowbirds were found to have a higher rate of predation, likely due in part to the loud begging calls by the cowbird nestling, but also partly explained by the fact that nests likely to be parasitized are also more likely to be preyed upon.[17][18]: 199
Unlike the common cuckoo, the brown-headed cowbird is not divided into gentes whose eggs imitate those of a particular host. Host species sometimes notice the cowbird egg, with different hosts reacting to the egg in different ways. Some, like the blue-grey gnatcatcher, abandon their nest, losing their own eggs as well. Others, like the American yellow warbler, bury the foreign egg under nest material, where it perishes.[19] The brown thrasher physically ejects the egg from the nest.[14] Experiments with grey catbirds, a known cowbird host, have shown that this species rejects cowbird eggs more than 95% of the time. For this species, the cost of accepting cowbird eggs (i.e. the loss of their own eggs or nestlings through starvation or the actions of the nestling cowbird) was far higher than the cost of rejecting those eggs (i.e. where the host might conceivably eject its own egg accidentally).[20] Brown-headed cowbird nestlings are also sometimes expelled from the nest. Nestlings of host species can also alter their behavior in response to the presence of a cowbird nestling.
Song sparrow nestlings in parasitized nests alter their vocalizations in frequency and amplitude so that they resemble the cowbird nestling, and these nestlings tend to be fed equally often as nestlings in unparasitized nests.[21]
Brown-headed cowbirds seem to periodically check on their eggs and young after they have deposited them. Removal of the parasitic egg may trigger a retaliatory reaction termed "mafia behavior". According to one study the cowbird returned to ransack the nests of a range of host species 56% of the time when their egg was removed. In addition, the cowbird also destroyed nests in a type of "farming behavior" to force the hosts to build new ones. The cowbirds then laid their eggs in the new nests 85% of the time.[22]
Young cowbirds are not exposed to species-typical visual and auditory information like other birds. Despite this, they are able to develop species-typical singing, social, and breeding behaviors.[23] Cowbird brains are wired to respond to the vocalizations of other cowbirds, allowing young to find and join flocks of their own species. These vocalizations are consistent across all cowbird populations, and serve as a sort of species-recognition password. If a young cowbird is not exposed to these "password" vocalizations by a certain age, it will mistakenly imprint on the host species.[24]
Social behaviors of cowbird males include aggressive, competitive singing bouts with other males and pair bonding and monogamy with females.
By manipulating demographics so juveniles only had access to females, juvenile males developed atypical social behavior; they did not engage in the typical social singing bouts with other males, did not pair bond with females, and were promiscuous. This demonstrates that great flexibility occurs in the behavior of cowbirds, and that the social environment is extremely important in structuring their behavior. Adult males housed with juvenile males were shown to have greater reproductive success compared to adult males housed with other adult males. Being housed with juvenile males honed the reproductive skills of the adult males by providing them with a more complex social environment.
This finding was further studied by comparing the behaviors and reproductive success of males exposed to a dynamic flock, consisting of changing individuals, with males exposed to a static group of individuals. The individuals that stayed with the same group (i.e., static flock) had a stable, predictable relationship between social behavior and reproductive success; the males that sang frequently to females experienced the greatest reproductive success. The adult males that were exposed to a rotating roster of new individuals (i.e., dynamic flock) had an unpredictable relationship between social variables and reproductive success; these males were able to copulate using a much greater variety of social strategies. The males that lived in static flocks had high levels of consistency in their behaviors and reproductive success across multiple years, whereas the males in dynamic flocks experienced varying levels of dominance with other males, differing levels of singing to females, and differing levels of reproductive success.[23]
With the expansion of its range and its parasitic behavior, the brown-headed cowbird is often regarded as a pest. People sometimes engage in cowbird control programs, with the intention of protecting species negatively impacted by the cowbirds' brood parasitism. A study of nests of Bell's vireo highlighted a potential limitation of these control programs, demonstrating that removal of cowbirds from a site may create an unintended consequence of increasing cowbird productivity on that site, because with fewer cowbirds, fewer parasitized nests are deserted, resulting in greater nest success for cowbirds.[25]
The brown-headed cowbird (Molothrus ater) is a small, obligate brood parasitic icterid native to temperate and subtropical North America. It is a permanent resident in the southern parts of its range; northern birds migrate to the southern United States and Mexico in winter, returning to their summer habitat around March or April.
La Brunkapa molotro (Molothrus ater) estas specio de birdoj de la familio de Ikteredoj kaj genro de molotroj kiu enhavas 5 speciojn de nestoparazitaj birdoj. Tiu specio fakte suferis malpliiĝon fine de la 20a jarcento kaj komence de la 21a pro kampanjoj kiuj celas forigon de tiu ĉi specio por savi aliajn endanĝerigitajn speciojn kiuj siavice estis suferantaj la parazitadon de la molotroj kaj malaperon de sia propraj idaroj.
Ĝi reproduktiĝas en moderklimata al subtropika Nordameriko nome el plej suda kaj sudokcidenta Kanado tra tuta Usono al centra Meksiko. Ili estas konstante loĝantaj birdoj en sudaj partoj de sia teritorio; nordaj birdoj migras al suda Usono eĉ al Florido kaj tuta Meksiko krome sude kaj marborde vintre, kaj revenas al la someraj habitatoj ĉirkaŭ marto aŭ aprilo.[1]
Ili similas al la Ikteroj laŭ ĝenerala formo sed havas fringecajn kapon kaj mallongan, fortan kaj preskaŭ konusforman bekon. Plenkreskuloj havas mallongan fringecan bekon kaj malhelbrunajn okulojn. Tiu ĉi specio estas klara kazo de seksa duformismo. Maskla plenkreskulo estas ĉefe brilnigra kun tre bruna kapo kio nuanciĝas ĉebruste, tiu bruna kapo estas stranga inter molotroj. Briloj estas iom verdecaj aŭ bluecaj ĉefe ĉe ŝultroj kaj dorso. Ina plenkreskulo estas griza kun helaj kapo, gorĝo kaj fajna strieco en subaj partoj.
Bekoj kaj kruroj estas malhelgrizaj.
Junuloj similas al inoj, sed ties subaj partoj estas fajne striecaj kaj ties dorso aspektas iel skvameca pro la fajnaj grizaj bordoj de la plumoj.
Inoj estas averaĝe pli malgrandaj ol maskloj. Plenkreskuloj estas 15 al 20 cm longaj[2][3] kaj havas enverguron de 32 al 38 cm. Ili pezas de 38 al 50 g[4].
La Brunkapa molotro povas foje estis konfuzita kun aliaj specioj.
La ino povas esti konfuzata kun tiu de la Ruĝaflugila agelajo, sed tiu lasta havas pliajn malhelajn markojn bruste kaj montras malhelgrizan dorson kaj helan superokulan strion.
De malproksime kaj laŭ la lumo, la kapo de la masklo povas ŝajni pli malhela kaj tiam estos malfacile distingi lin el aliaj nigraj birdoj de brila plumaro de la samaj regionoj. Tiele li estas foje konfuzata kun kelkaj Ikteredoj kiaj la Komuna kviskalo aŭ la Purpurkapa eŭfago, sed tiuj lastaj estas pli dikaj, havas pli longajn vostojn, havas bluajn nuancojn en la plumaro kaj havas flavajn okulojn kaj ne nigrajn. La Brunkapa molotro povas esti konfuzata ankaŭ kun aliaj molotroj, kiaj la Bronzomolotro aŭ la Brila molotro kiuj ĉiukaze havas pli longajn bekojn kaj estas tute nigraj, sen ia bruna surkape; la Bronzomolotro krome havas ruĝajn okulojn kaj bluviolajn nuancojn ĉe flugiloj[5].
Ili loĝas en malfermaj aŭ duonmalfermaj kamparoj kaj ofte veturas are en multnombraj birdaroj, foje mikse kun la Ruĝaflugila agelajo (ĉefe printempe) kaj kun la Dolikonikso (ĉefe aŭtune), same kiel kun la Komuna kviskalo aŭ la Eŭropa sturno.[1]
Tiele ne raras vidi tiun birdon ene de nuboj enhavantaj centon da miloj de individuoj[6]. Una nubo de birdoj formita en Kentukio, enhavantaj kelkajn speciojn inter kiuj la Brunkapa molotro, estis ĉirkaŭkalkulita je pli da kvin milionoj de individuoj[7]. Nokte la Brunkapa molotro ripozas ankaŭ en komunaj dormejoj[8].
Ili evitas tre densajn arbarojn, ekzemple de koniferoj.
Tiuj birdoj manĝas surgrunde, kie piediras pli ol saltetas, ofte sekvante paŝtantajn animalojn kiaj ĉevaloj kaj bovoj por kapti insektojn movigatajn de tiuj grandaj animaloj. Ili manĝas ĉefe semojn kaj insektojn.
Antaŭ la eŭropa setliĝo, la Brunkapa molotro sekvis la arojn de bizonoj tra la prerioj. Ties parazita nestokutimaro kongruis kun tiu nomadeca vivostilo. Ties nombroj etendiĝis pro la klarigado de arbaroj areoj kaj la enmeto de novaj paŝtejaj animaloj fare de setlantoj tra Nordameriko. Nune la Brunkapaj molotroj estas komune vidataj ĉe ĉeurbaj birdomanĝejoj.
La Brunkapa molotro manĝas ĉefe semojn kiuj faras tri kvaronojn de ties nutrado. Temas ĉefe pri semoj de herboj de prerio, sed ili konsumas ankaŭ kultivitan grenon. Kvarono de ties nutrado estas konstituata de insektoj, kiaj akridoj kaj diversaj koleopteroj. La Brunkapa molotro estas multe pli insektovoraj dum la reprodukta sezono, ĉefe inoj.
La inoj de Brunkapa molotro demetas grandajn nombrojn de ovojn kaj bezonas kalcion. Por tia celo, ili konsumas konkojn de helikojn, kaj foje eĉ la ovon, kiujn ili forigis el la parazitita nesto[4].
Tiu birdo estas nestoparazito: la ino demetas siajn ovojn en nestoj de aliaj malgrandaj paserinoj, ĉefe tiuj kiuj konstruas tasformajn nestojn kaj kiuj konsumas grenon sed ankaŭ insektojn. La ovoj de la Brunkapa molotro estis bone dokumentitaj en nestoj de almenaŭ 220 gastigantaj specioj, inklude kolibrojn kaj rabobirdojn.[9] (Ortega 1998) Junaj molotridoj estas manĝigataj de la gastigantaj gepatroj malprofite por siaj propraj idoj. La idoj de la gastigantaj gepatroj se ili ne estis forigitaj de la molotroj, malsatmortos (ĉar la molotrido plie kreskos) aŭ eĉ estos forigitaj de la molotrido.
Inoj de Brunkapa molotro povas demeti 36 ovojn en unu sezono. Oni scias ke ĝis pli da 140 diversaj specioj de birdoj zorgis molotridojn.[10]
Inter la plej komunaj gastigantoj, oni citu la speciojn de la Ora parulio, la Melodia melospizo, la Paserspizelo, la Orienta febo, la Ruĝokula vireo, la Ruĝflanka pipilo, la Makula pipilo kaj la Ruĝaflugila agelajo[4]. Tiu nestoparazitado povas esti problemiga kiam temas pri specioj kies populacioj estas jam malpliiĝantaj, kiel ĉe la Kirtlanda parulio, la Nigrakapa vireo[4] aŭ la Bella vireo[11].
Malkiel la Kukolo, ĝi ne havas genojn kies ovoj imitas tiujn de preciza gastiganto.
Gastigantaj gepatroj povas foje facile rimarki la molotrovojn, je kio diversaj gastigantaj specioj reagas diference. Malakcepto povas okazi laŭ tri formoj: nestabandono (ekz. ĉe Blugriza polioptilo), enterigo de la ovo sub nova nestomaterialo (ekz. ĉe Ora parulio)[12], kaj fizika forigo de la ovo el la nesto (ekz. ĉe Bruna toksostomo).[13]
Ankaŭ idoj de la Brunkapa molotro estas foje forigitaj el la nesto ekzemple fare de la Bruna toksostomo[14] aŭ de la Poliglota toksostomo[15].
La Blugriza polioptilo povas abandoni la parazititan neston, ĉefe kiam la Molotrino demetas saijn ovojn antaŭ kiam la polioptilo finis ovodemeti siajn proprajn[16].
La Ruĝkapa karpodako manĝigas sian idon per vegetarana dieto, kiu estas netaŭga por la idoj de la Brunkapa molotro. Kvankam la ovoj de Brunkapa molotro demetataj en nesto de Ruĝkapa karpodako atingos eloviĝon, preskaŭ neniu survivos ĝis elnestiĝo.[17]
Ŝajne la Brunkapaj molotroj foje kontrolas siajn ovojn kaj idojn post la ovodemetado. Forigo de la parazita ovo povas eksplodigi kutimaran reagon konata laŭ la termino "mafia kutimo". Laŭ studo de la Florida Museum of Natural History publikita en 2007, la molotro revenas detrui la nestojn de ia gamo de gastigantaj specioj (56 % de la kazoj). Krome la molotro detruas nestojn kiel ia "farmiga kutimo" por devigi la gastigantojn konstrui novajn nestojn. Tiam la molotroj demetos siajn ovojn en la novaj nestoj je 85 % de la kazoj.[18]
Printempe reproduktaj plenkreskuloj ariĝas en arbara zono por komenci la pariĝadon. Ĉe kelkaj populacioj (ĉefe tiuj de Kansaso), ne estas parligoj kaj inoj pariĝas kun diversaj partneroj kaj inverse; dum ĉe aliaj (ĉefe en Kalifornio), funkcias la monogamio[19][20].
La pariĝa ceremonio, realigata foje are fare de maskloj, enhavas kantojn kaj sintenojn. Ili levas ŝultrojn, ŝveligas ŝultrajn kaj dorsajn plumojn kaj salutas profonde, dum ili malfermas la voston kiel ventumilo kaj finas memmontradon per frotado de la beko sur branĉo[21].
La ovodemeto okazas el majo al fino de junio[22]. Post seksumado la inoj serĉas parazitotajn nestojn. Por tio ili serĉas birdojn kiuj montras konstrukutimon aŭ eĉ rekte kiuj eliras el nesto. Ili preferas ovodemeti ĉe tasformaj nestoj sed ankaŭ ĉe surgrundaj, pendataj aŭ situaj en kavaĵo de arbotrunko[4]. Kiam la parazitota nesto estis elektita, ili forigas ovon de la ovaro de la gastiganto kaj ovodemetas anstataŭe.
La molotrinoj povas demeti ĝis 36 ovojn dum unu reprodukta sezono. Tiuj ovoj estas 1,8–2.5 cm×1,5–1.8 cm kaj estas blankaj aŭ grizblankecaj, forte makulitaj de bruna aŭ malhelgriza[4]. La kovado daŭras 11 tagojn averaĝe (de 10 al 12 tagoj). La molotridoj pezas dumnaske apenaŭ pli da du gramoj[23]. Ilo estas nudaj kaj blindaj. Ili grandiĝas pli rapide ol la adoptaj gefratoj, kio permesas ilin profiti atenton kaj zorgon de la adoptaj gepatroj. Ili elnestiĝas post 8 al 13 tagoj[4], sed junuloj restas dependaj de la adoptaj gepatroj ĝis aĝo de 25 al 39 tagoj[24]. Estas nur unu ovosezono jare[23].
La rekordo de vivodaŭro ĉe tiu specio estas de 16 jaroj kaj 9 monatoj por individuo en naturo[25]. Seksa matureco estas akirita post unu jaro, sed maskloj pariĝas rare antaŭ la aĝo de du jaroj[23][26].
Kelkaj grandas rabobirdoj kiaj la Marĉostrigo kaj la Granda kornostrigo povas ataki kaj la molotrojn kaj la molotridojn. Tiuj lastaj estas predoj ankaŭ de serpentoj kaj de la Blua garolo[26].
Tiu specio estis unuafoje priskribita de Pieter Boddaert en 1783 laŭ la nomo Oriolus ater. Ĝi ricevis poste aliajn sciencajn nomojn kiel jenaj: Icterus pecoris de Charles Lucien Bonaparte en 1824, Molothrus pecoris de William Swainson en 1831, kaj Fringilla ambigua de Thomas Nuttall en 1832. En 1870 la specio ricevis sian nunan sciencan nomon Molothrus ater, atribuita de George Robert Gray[27].
Molothrus ater havas tri subspeciojn[28]:
La IUCN klasis tiun specion en la kategorio Malplej Zorgiga, pro ties granda teritorio (ĉ. 11 milionoj de km²) kaj grava populacio (ĉ. 56 milionoj de individuoj)[29]. La specio tamen estas protektita, kiel ĉiuj migrantaj usonaj birdoj, fare de la Migratory Bird Treaty Act[30]
En kelkaj subŝtatoj de Usono, kiaj ekzemple Miĉigano, la Brunkapa molotro estas ĉu kaptata ĉu pafata por malpliigi la indicon de parazitado suferata de minacataj specioj. Komence de la 1970-aj jaroj, la populacioj de la Kirtlanda parulio estis ege malmultnombraj (malpli de 170 paroj). Okazis en 1972 en Miĉigano kampanjo de forigo de la Brunkapa molotro kune kun klopodoj por pluestigi la tre specialan habitaton de tiu parulio, kio permesis la stabiligon de la populacioj de la endanĝerita specio kiu ĝuis ioman pliiĝon komence de la 1990-aj jaroj. Ankaŭ tio sukcesis ĉe la Bella vireo, post kaptado de la Brunkapa molotro en la ĉeriveraj areoj okupataj de tiu minacata specio[26].
Tiu forigo estigas etikajn kaj jurajn problemojn. Fakte la Brunkapa molotro estas censita protektita estaĵo fare de la Migratory Bird Treaty Act. Pro tio tiu sistemo povas esti nur provizora solvo: la savado de la minacataj specioj devas veni de restaŭrado de ties natura habitato, nome arbaro sufiĉe granda por ke la Brunkapa molotro ne atingu ties nestojn. Tamen necesus tro granda rearbarigado ekzemple en Teksaso[26].
La Brunkapa molotro (Molothrus ater) estas specio de birdoj de la familio de Ikteredoj kaj genro de molotroj kiu enhavas 5 speciojn de nestoparazitaj birdoj. Tiu specio fakte suferis malpliiĝon fine de la 20a jarcento kaj komence de la 21a pro kampanjoj kiuj celas forigon de tiu ĉi specio por savi aliajn endanĝerigitajn speciojn kiuj siavice estis suferantaj la parazitadon de la molotroj kaj malaperon de sia propraj idaroj.
Ĝi reproduktiĝas en moderklimata al subtropika Nordameriko nome el plej suda kaj sudokcidenta Kanado tra tuta Usono al centra Meksiko. Ili estas konstante loĝantaj birdoj en sudaj partoj de sia teritorio; nordaj birdoj migras al suda Usono eĉ al Florido kaj tuta Meksiko krome sude kaj marborde vintre, kaj revenas al la someraj habitatoj ĉirkaŭ marto aŭ aprilo.
El tordo cabecicafé (Molothrus ater),[7] también conocido como tordo cabecipardo,[8] tordo negro,[9][10] tordo negro común,[9] tordo cabeza marrón,[9] tordo cabeza café,[3][7][11] tordo cuco,[12] vaquero cabecicafé,[7] vaquero de cabeza castaña[7] o boyero negro,[13] es una especie de ave paseriforme de la familia Icteridae propia de América del Norte. Es un pájaro de hábitos parcialmente migratorios que habita en las regiones norteamericanas de clima templado y subtropical.[13] Es sedentario en las regiones australes de su área de distribución, mientras que las aves del norte, en cambio, migran al sur de los Estados Unidos y a México en invierno y regresan a su hábitat de verano en marzo o abril.[14] Se trata de una especie abundante y ampliamente distribuida, de comportamiento gregario,[10] que se alimenta fundamentalmente de semillas y artrópodos.[15]
Exhibe un marcado dimorfismo sexual,[9] y es conocido por ser el parásito de puesta más común de América del norte, depositando sus huevos en nidos de más de 220 especies de aves, reduciendo el éxito reproductivo y amenazando la supervivencia de algunas de ellas.[10] A pesar de compartir esta particular estrategia reproductiva con muchas especies de cucos, no está emparentado con ellos, sino que se trata de un caso de convergencia evolutiva.
Antes del asentamiento europeo, el tordo cabecicafé seguía las manadas de bisontes (Bison bison) a través de las Grandes Llanuras,[6] y quizá también al antílope americano (Antilocapra americana) y al uapití (Cervus canadensis).[16] El parasitismo de puesta complementaba este estilo de vida nómade.[17] Su número creció con la creación de nuevos hábitats abiertos por parte de los colonizadores. Invadió los estados a orillas de los Grandes Lagos y el noreste de Estados Unidos durante el siglo XIX.[2] También se diseminó hacia el oeste, llegando a California.[2] En la actualidad, es posible verlos alimentándose en comederos para aves en áreas suburbanas.
El tordo cabecicafé es una especie del género Molothrus y pertenece a la familia de los ictéridos, la cual comprende a aves paseriformes oriundas de América del norte y del sur.[3][15] Molothrus significa "vagabundo" en griego y ater quiere decir "negro" en latín, aludiendo a su estilo de vida nómade y al color predominante del plumaje del macho.[18][19] Existen tres subespecies reconocidas, que se diferencian principalmente por su tamaño y por la oscuridad del plumaje de las hembras, aunque no son distinguibles en el trabajo de campo:[20] M. a. artemisiae (Gran Cuenca),[21] M. a. ater (Medio Oeste y este de los Estados Unidos)[4][6] y M. a. obscurus (desiertos del sudoeste y costa del Pacífico).[21] Los machos jóvenes de M. a. artemisiae presentan una mayor tendencia a agruparse en bandadas únicamente de juveniles, mientras que los de M. a. ater son más proclives a unirse a bandadas de individuos de distintas edades.[22]
En la actualidad, dos subespecies de tordo cabecicafé se reproducen en California. M. a. artemisiae probablemente siempre haya sido un residente raro en verano en las porciones del estado incluidas dentro de la Gran Cuenca y un visitante invernal también raro en el resto de California (Grinnell, 1915; Mailliard, 1927). Aunque su abundancia ha aumentado, su área de distribución se mantuvo constante. Por otro lado, de acuerdo con Laymon (1987), el estatus de M. a. obscurus había cambiado notablemente durante los previos 120 años y esta subespecie sería aparentemente la responsable de la sustancial disminución del éxito reproductivo de ciertos paseriformes del Valle Central y el sur de California.[23] La cruza entre M. a. artemisiae y M. a. obscurus ha estado ocurriendo desde que ambas subespecies se pusieron en contacto en la década de 1930 en la Sierra Nevada; el tamaño de M. a. artemisiae se redujo en el área en donde convive con la otra subespecie, la cual naturalmente presenta una talla menor.[4][21]
Fleischer y Rothstein (1988) afirmaron que dos subspecies morfológicamente distintas ocupaban las respectivas laderas de la Sierra Nevada: M. a artemisiae sobre la ladera oriental y M. a. obscurus sobre la occidental. Las poblaciones de obscurus llegaron a California desde el bajo río Colorado alrededor del 1900 e invadieron el oeste de la Sierra Nevada durante la década de 1930. Poblaciones de obscurus apartadas entre sí por distancias de hasta 700 km producían un silbido relativamente constante en vuelo, mientras que los artemisiae del este presentaban numerosos dialectos.[21]
Las medidas medias de siete mediciones morfológicas para 2.287 individuos mostraban patrones similares en cuanto a tamaño corporal para machos adultos, machos de un año de edad y hembras dentro de segmentos latitudinales de 60 km a lo largo del este de la Sierra Nevada: en el punto de estudio más austral en Bishop se registraron tallas grandes, las cuales se reducían gradualmente hacia el norte hasta Mammoth Lakes y luego comenzaban a aumentar nuevamente en dirección norte hasta Lee Vining, el sitio de estudio más septentrional.[21]
Mientras que la información recolectada no indica un origen adaptativo para estas variaciones, una explicación más conservadora sugiere un flujo de genes de obscurus en las poblaciones de artemisiae en el área de Mammoth Lakes. No es sorpresa que la cresta de la Sierra Nevada en Mammoth Lakes sea considerablemente menos elevada que en cualquier otro punto 80 km al norte y 180 km al sur.[21]
Otros dos descubrimientos respaldaron esta suposición. En primer lugar, los ejemplares de mayor longitud alar (recogidos en Bishop y en Lee Vining) presentaban alas significativamente más cortas que las de los tordos cabecicafé recolectados en la misma región entre 1912 y 1922. En segundo lugar, el largo de las alas de machos adultos y hembras en Mammoth Lakes entre 1978 y 1981 era significativamente mayor que el de los individuos del período 1982 – 1985.[21]
Esta presunta hibridación debe haber sido rápida puesto que pasaron menos de cincuenta años entre el contacto entre ambas subespecies por primera vez y el comienzo del estudio de Fleischer y Rothstein. La transferencia de genes se produjo entre dos subespecies con distintos silbidos en vuelo y entre varios dialectos de silbidos dentro de artemisiae. Por lo tanto, las diferencias vocales entre estos dialectos no parecen ser un importante elemento disuasorio del entrecruzamiento.[21]
El tordo cabecicafé es un ictérido pequeño.[2][10] El macho mide 19 - 22 cm, con un peso de entre 42 y 50 g.[10] La longitud de la hembra oscila entre los 16 y 20 cm y pesa 38 - 45 g.[10] Generalmente, su reducido tamaño es suficiente para diferenciarlo de otras especies en bandadas mixtas, incluso cuando su coloración no es distinguible.[19] El pico es cónico,[2][15] más corto y de base más ancha que en otros ictéridos,[10] negro en el macho y en la hembra oscuro en la mitad superior y pálido en la mandíbula inferior.[20] Los ojos son oscuros y las patas, negras.[20] Las alas son largas y en punta.[2][15] Su cola es más corta —una característica distintiva en vuelo— y su cabeza, más robusta que en la mayoría de los miembros de su familia.[10]
El plumaje del macho adulto es predominantemente negro iridiscente, con la cabeza, el cuello y el pecho marrones,[9][13] lo que lo diferencia de especies similares tales como el tordo ojo rojo (Molothrus aeneus) y el tordo renegrido (Molothrus bonariensis).[10] Visto en la luz, su iridiscencia es menor que la de los zanates (Quiscalus spp.) y la del tordo ojo amarillo (Euphagus cyanocephalus).[10] La hembra, de color marrón o gris, presenta una tonalidad más oscura sobre las alas y cola[20] y más clara sobre la cabeza y el vientre, con finas vetas en el abdomen y pecho, mucho más sutiles que las de la hembra de tordo sargento (Agelaius phoeniceus).[10] Su garganta blanquecina contrasta con su cara más oscura.[20] Incluso ella presenta indicios de iridiscencia verdosa, aunque su coloración más apagada le brinda un buen camuflaje mientras busca nidos en los que depositar sus huevos.[18][24] Los juveniles son más veteados y claros que las hembras adultas,[20][25] y las puntas de sus plumas son más pálidas, lo que le da a su dorso una apariencia escamosa.[20][26]
Los cambios en el plumaje del tordo cabecicafé son bastante simples. El plumón natal fue caracterizado por el ornitólogo Jonathan Dwight (1900) como oliva grisáceo. Describió el plumaje juvenil, común a ambos sexos, de la siguiente manera: “Arriba, incluyendo los costados de la cabeza y el cuello, las alas y la cola, oliva amarronado oscuro, las plumas con un borde beige claro, blancuzco sobre las primarias. Abajo, blanco apagado, beige sobre la garganta, pecho y flancos con muchas vetas oliva amarronado. El mentón es blanco o amarillento.” En agosto o a comienzos de septiembre se produce una muda postnupcial completa, dando lugar al primer plumaje de invierno que es indistinguible del de los adultos. Mientras mudan sus plumas, los machos jóvenes se vuelven llamativos debido a que las lustrosas plumas negras de su nuevo plumaje emergen esparcidas entre las viejas plumas marrones, dándoles una curiosa apariencia moteada. En el macho, la cabeza, el cuello y la nuca son de una especie de marrón violáceo, pero el resto del plumaje, incluyendo las alas y la cola, es de un negro lustroso con reflejos verdes y púrpuras. La hembra adquiere su coloración “gris ratón”. Los adultos atraviesan una muda total en septiembre pero no sufren una muda prenupcial,[19] a diferencia de lo que sucede con el tordo arrocero (Dolichonyx oryzivorus).[27]
El tordo cabecicafé es una especie neártica originaria de las Grandes Llanuras. Su área de distribución ha estado en constante crecimiento durante los siglos XIX y XX y actualmente cubre la mayor parte del territorio estadounidense y mexicano y grandes extensiones en el sur y oeste de Canadá. Su número aumentó con la deforestación de los bosques, la introducción de nuevos animales de pasturas por parte de los colonizadores europeos, la urbanización y la conversión de los hábitats boscosos en terrenos agrícolas.[2][16] Para fines de la década del 2000 o principios de la de 2010, su área de distribución —incluyendo tanto las zonas de reproducción como las de migración invernal— se extendía sobre aproximadamente 11.200.000 km²,[28] lo que equivale a un 46% de la superficie norteamericana. A pesar de la idea comúnmente aceptada de que en un principio habitaba sólo en las Grandes Llanuras, la existencia de tres subespecies distintas podría sugerir que su área de distribución original era más amplia.[20]
Graham (1988) y Rothstein (1994) identificaron al tordo cabecicafé como la especie que había experimentado la mayor expansión en su distribución entre todas las aves norteamericanas.[29] En el siglo XIX, se propagó por el este de América del norte.[30] Durante el siglo XX, se diseminó hacia el oeste, haciendo que su área de distribucìón cubriera entonces los 48 estados americanos contiguos y todo el sur de Canadá.[24] La conquista de los estados occidentales se debe en gran parte a la rápida colonización del M. ater obscurus.[4][23][31] Se ha afirmado que el hecho de que las áreas de reproducción y alimentación estén separadas entre sí contribuyó de manera importante a esta expansión.[4][31] Debido a que los tordos cabecicafé pueden volar hasta 7 km entre unas y otras, el surgimiento de nuevos hábitats en los que alimentarse (corrales de caballos, zonas residenciales con comederos para aves, etc.) dentro de lo que antes era bosque cerrado supuso consecuentemente el uso de nuevas áreas para reproducirse.[4][31]
Antes del 1800, el tordo cabecicafé habitaba fundamentalmente en las praderas al oeste del río Misisipi. No se le encontraba en las vastas extensiones de bosque ininterrumpido que cubrían gran parte del este de América del norte debido a que sus hábitos alimenticios y su comportamiento social lo restringían a hábitats abiertos. A medida que los pobladores talaban los bosques orientales y despejaban el terreno para su uso en actividades agropecuarias, se originaron nuevos hábitats abiertos, los cuales favorecieron una expansión hacia el este por parte del tordo cabecicafé. Aparentemente, hacia fines del siglo XIX, la especie se había esparcido por el este de América del norte, pero no era abundante y vivía principalmente en áreas cultivadas. No era común en hábitats boscosos y, en ese entonces, el impacto de su parasitismo de puesta sobre el éxito reproductivo de los paseriformes del bosque era probablemente mínimo.[30]
En 1958, Arthur Cleveland Bent determinó que los valles de los ríos Potomac y Ohio eran los límites septentrionales del área de distribución invernal regular del tordo cabecicafé oriental, la cual se extendía hasta Florida y la costa del Golfo de México.[19]
No se sabe a ciencia cierta si M. a. obscurus habitaba a orillas del río Colorado antes de 1870, cuando fue documentado reproduciéndose allí por primera vez (Laymon, 1987). Sin embargo, existe un único registro al oeste de ese río anterior a 1870: en la ladera este de las montañas Cuyamaca (condado de San Diego, extremo sudoeste de California) en 1862. Según los registros, su área de distribución se expandió rápidamente hacia el oeste y el norte entre 1900 y 1930. Para 1925 era común en el área de Los Ángeles y para 1930 se había esparcido al área de la bahía de San Francisco y el valle de Sacramento central. Para 1941 se había diseminado por el condado de Humboldt (noroeste del estado) y para 1960, alcanzado el condado de Del Norte (extremo noroeste), el límite con Oregón y los prados de mayor altitud de la Sierra Nevada.[23] Rothstein y otros (1980) documentaron la reciente expansión en el área de distribución del tordo cabecicafé en la Sierra Nevada, advirtiendo que el ave no era avistada allí antes de 1930, pero parecía estar ampliamente distribuida para entonces sobre la mayoría o la totalidad de las monatañas.[32]
En términos relativos, podría decirse que los tordos cabecicafé son recién llegados en Washington. Si bien pudieron haber estado presentes allí en pequeños números desde antes, generalmente se considera que arribaron a la cuenca de Columbia a finales del siglo XIX. Para 1955 eran vistos con regularidad en el oeste de Washington, y para 1958 ya se reproducían en esa zona del estado.[33]
Se desconoce la fecha exacta de la llegada del tordo cabecicafé a Columbia Británica. El primer registro, procedente del área de Revelstoke, fue de mayo de 1890. Los reportes más tempranos de esta ave fueron del sur de la provincia e incluso para 1930 la mayoría de los registros correspondían a las zonas meridionales del interior (es decir, el sur y el sudeste de Columbia Británica). Para 1950, el tordo cabecicafé había sido documentado en las ecoprovincias interior central (centro-sur de Columbia Británica) e interior sub-boreal (centro-norte), pero aún era una especie rara a lo largo de la costa. Eso cambió a finales de la década de 1950 y principios de la de 1960, y para 1970 el tordo cabecicafé podía ser encontrado en hábitats adecuados en toda la longitud de la costa, incluyendo gran parte de la isla de Vancouver. Al mismo tiempo, era registrado en más sitios y probablemente su abundancia aumentaba en el interior de la provincia al sur del paralelo 56° norte. Para 1990, podía hallársele en toda Columbia Británica, incluyendo las zonas más septentrionales de las montañas boreales del norte (norte y noroeste de la provincia) y de las llanuras de taiga (noreste).[29]
En la actualidad, su área de reproducción se extiende desde el sudeste de Alaska, norte de Columbia Británica, sur de los Territorios del Noroeste, norte de Alberta y centro-norte de Saskatchewan, hacia el este hasta el sur de Manitoba, de Ontario, de Quebec y de Terranova,[34] Nuevo Brunswick, Nueva Escocia y la Isla del Príncipe Eduardo (Canadá),[35] cubriendo todos los Estados Unidos continentales, hasta Florida central y la costa del Golfo, continuando hacia el sur de México —Oaxaca y Veracruz—[29] y, en el noroeste de dicho país, hasta el norte de Baja California.[4][15][36] Según Peter E. Lowther (1993), anida también en el sudeste del territorio canadiense de Yukón.[6][35] Su parasitismo ha sido detectado incluso en nidos de gorriones de Ipswich (Passerculus sandwichensis princeps) sobre la remota isla Sable, al sudeste de Nueva Escocia (Stobo y McLaren, 1975).[37]
De acuerdo con Richard M. DeGraaf y otros (1991), pasa el invierno desde el norte de California, Arizona central, los estados a orillas de los Grandes Lagos y Nueva Inglaterra, hacia el sur hasta México meridional,[9] la costa del Golfo y el extremo de la península de Florida.[4][15][38] Otras fuentes incluyen también en su área de distribución invernal el sudoeste de Columbia Británica, oeste de los estados sobre el océano Pacífico, sur de Utah, porciones meridionales de Ontario, Nuevo Brunswick y Nueva Escocia.[29] Según Peterson y Chalif (1989), habita en todo el territorio mexicano, excepto en Chiapas, Tabasco, Campeche, Quintana Roo y Yucatán.[9] Si bien reside durante el año entero en el sur de los Estados Unidos, puede hallársele en regiones septentrionales y montañosas sólo durante la temporada reproductiva.[2]
Según información de la Seattle Audubon Society para la década del 2000, es posible encontrarlo durante los meses invernales en los feedlots del este de Washington. Asimismo, en el oeste de dicho estado, grandes cantidades de tordos cabecicafé son vistas durante todo el año en los alrededores de Kent (condado de King).[33]
De acuerdo con un estudio de Root y Weckstein (1994) basado en información recolectada durante buena parte del siglo XX, su área de distribución invernal se había extendido hacia la región noreste (Maine y Nueva Escocia), reduciéndose en otros lugares a lo largo de los confines septentrionales de la misma (Pensilvania, Míchigan, Wisconsin, Iowa, Montana y Washington). Las razones que explican esta disminución son indudablemente complejas, pero uno de los factores más relevantes pudo haber sido el control poblacional a través de la captura con trampas durante la temporada reproductiva en Míchigan, por parte del Servicio de Pesca y Vida Silvestre de los Estados Unidos y el Departamento de Recursos Naturales de ese estado a fin de preservar al chipe de Kirtland (Dendroica kirtlandii), amenazado por el parasitismo. Para 1980, se habían eliminado ya 40 mil ejemplares de la especie parasítica.[39]
Según datos publicados en 1993, la tasa de supervivencia anual de los adultos es de un 48,5% para los machos y 40,4% para las hembras.[4][6] La fecundidad de una hembra promedio en su vida entera es de 80 huevos,[4][6] unos 40 por año a lo largo de dos años.[40] Los estudios probaron que sólo un 3% de los huevos de tordo cabecicafé producirá polluelos que lleguen a la adultez, lo cual se compensa con la gran cantidad de huevos depositados, dando una descendencia promedio de 2,4 ejemplares adultos por hembra.[25][40]
De acuerdo con el ornitólogo Arthur Cleveland Bent (1958), la prevalente impresión de que los machos superan ampliamente a las hembras en número probablemente sea más aparente que real debido a que los primeros son más llamativos y menos reservados. El ornitólogo Herbert Friedmann (1929) concluyó de sus observaciones que habría unos tres machos por cada dos hembras.[19] Rothstein y otros (1986) y Yokel (1989) mencionaron que los machos representaban un porcentaje sensiblemente mayor al de las hembras sobre la población total de la especie, lo cual probablemente significaría que numerosos machos presentes en las áreas de búsqueda de nidos no tengan pareja y en realidad estén procurando una compañera.[16]
Las estimaciones de su población total en América del norte variaban entre los 20 y los 40 millones de individuos para 1972. En ese mismo año, se calculó que el número de tordos cabecicafé en Dakota del Norte sería de un millón de ejemplares.[4][41] La población estimada para 1957 en Illinois era de aproximadamente 1,1 millones.[4] Otras estimaciones manejan una cifra de alrededor de 56 millones de individuos maduros para 2010, distribuidos en un área de 11.200.000 km².[18][28] Debido a su abundancia, se le considera una especie bajo preocupación menor.[10][28]
El norte de las Grandes Llanuras es el área con mayor abundancia de tordos cabecicafé en Estados Unidos y Canadá.[16][35] De acuerdo con Robinson y otros (1993), entre los 48 estados contiguos los tordos cabecicafé son más abundantes en Dakota del Norte, Dakota del Sur, Nebraska, Kansas y Iowa; muy abundantes en Oklahoma y Misuri; moderadamente abundantes en Washington, Oregón, Idaho, Montana, Arizona, Texas, Luisiana, Arkansas, Misisipi, Tennessee, Kentucky, Maryland, Ohio, Indiana, Illinois, Míchigan, Wisconsin y Minnesota; y más escasos en California, Nevada, Utah, Wyoming, Colorado, Nuevo México, Alabama, Florida, Georgia, Carolina del Norte, Carolina del Sur, Virginia, Virginia Occidental, Pensilvania, Delaware, Nueva Jersey, Nueva York, Connecticut, Rhode Island, Massachusetts, Vermont, Nuevo Hampshire y Maine.[16]
De acuerdo con Laymon (1987), las mayores concentraciones de tordos cabecicafé en California en invierno se dan en el Valle de Sacramento, el Valle Imperial, el oeste del condado de Riverside y el sudoeste del de San Bernardino.[23] Quizá debido a la proximidad entre las áreas de alimentación y las de búsqueda de nidos, tienden a ser más abundantes en hábitats heterogéneos fragmentados en los que se combinen superficies cubiertas de césped con campos arbustivos en desuso y/o bosques.[16]
Algunas investigaciones sostienen que las poblaciones de tordos cabecicafé han crecido a lo largo del siglo XX en la mayor parte de Estados Unidos. En el noreste, sin embargo, han sufrido una disminución estadísticamente significativa.[16][42] La información de Breeding Bird Survey (BBS) de entre 1965 y 1979 indicaba que el número de tordos cabecicafé se había incrementado en el sudeste estadounidense, incluyendo Carolina del Norte, Carolina del Sur y el sur de Georgia.[4][43] Margaret Clark Brittingham y el ecologista aviar y biólogo de vida silvestre Stanley A. Temple (1983) concluyeron que la cantidad de ejemplares había estado creciendo constantemente entre 1900 y 1980 en los once estados meridionales al sur del paralelo 37° norte desde Texas hasta el océano Atlántico, a donde la mayoría de ejemplares del este migra para pasar los meses invernales. Este aumento en su abundancia probablemente se deba a una mayor disponibilidad de alimento y de hábitats en los que pasar el invierno. Los granos residuales que quedan esparcidos sobre los campos de arroz (Oryza sativa) en los estados sureños constituyen una importante fuente de alimento para varias especies de ictéridos, incluyendo el tordo cabecicafé, en esa época del año,[30] lo cual podría repercutir en una mayor tasa de supervivencia al invierno.[16][24] Un incremento en su éxito reproductivo derivado de la exposición a nuevas y vulnerables especies hospedadoras posiblemente también esté relacionado con esta tendencia.[16][24]
Conforme a un estudio publicado en 1993, las poblaciones de esta especie estaban reduciéndose en Arizona, aumentando ligeramente en Idaho e incrementándose marcadamente en Montana.[4][44] En Oregón, crecieron en los bosques de sabinas (Juniperus) entre 1899 y 1983, pero disminuyeron considerablemente en el estado en general.[4][6][45] En la Sierra Nevada, aumentaron entre 1966 y 1985.[4][46] Los datos de Breeding Bird Survey para el Medio Oeste sugieren un decrecimiento para el período 1966 - 1981 y un incremento entre 1982 y 1991.[4][47] Según Peter E. Lowther, aumentos demográficos significativos (información de BBS 1966 - 1987) se dieron en Georgia, Carolina del Norte, Iowa, Dakota del Norte, Utah y Colorado, mientras que se registraron disminuciones significativas en Minnesota, Míchigan, Wisconsin, Nueva York, Rhode Island, Ohio, Ontario (Canadá), Virginia Occidental, Tennessee, Nuevo Brunswick (Canadá), Oklahoma y Texas.[4][6] Si bien su población disminuyó considerablemente en Washington entre 1966 y 2002, aún son comunes y se encuentran ampliamente distribuidos en el estado.[33]
Una interpretación alternativa de la información de BBS por parte de James R. Herkert señalaría una tendencia generalmente negativa para los Estados Unidos, pero un marcado crecimiento en Illinois durante el período 1966 - 1991.[4][48] Según la National Geographic (2006), su número había estado en descenso recientemente.[20] Butcher y Niven (2007) argumentan que la especie ha sufrido una disminución pequeña o estadísticamente insignificante en su población en América del norte en su conjunto durante las últimas cuatro décadas.[28]
Las observaciones de tordos cabecicafé en el interior de la Columbia Británica se mantuvieron relativamente estables desde la década de 1930 hasta la de 1950, mientras que los avistamientos sobre la costa —en donde proporcionalmente hay más observadores— fueron escasos entre los años 1930 y 1940, pero comenzaron a incrementarse en los ‘50 a medida que las aves empezaban a colonizar estas áreas. Importantes aumentos en el número de avistamientos y en la cantidad de ejemplares por avistamiento se produjeron en la década de 1960. En los ‘80, esta tendencia positiva se mantuvo en el interior, pero se revirtió en la costa.[29]
Un análisis de la información de las Breeding Bird Surveys en la Columbia Británica para el período 1968 – 1993 muestra que el número de tordos cabecicafé sobre la costa había disminuido un 4% anual en promedio; en un análisis de los datos del interior de la provincia para el mismo período, no se detectaron cambios netos en la cantidad de individuos. A lo largo de Canadá, los datos de las BBS indican una disminución poblacional; desde 1960 a 1996, su número cayó en promedio un 2% cada año. En la totalidad de su área de distribución, la información sugiere que su cantidad se redujo un 0,8% anual promedio en el mismo período (Sauer y otros, 1997).[29]
Se le encuentra en hábitats abiertos y semiabiertos, incluyendo áreas de esas características en las cercanías de terrenos agrícolas,[2][9] márgenes de bosques,[9][15] bosques de coníferas y caducifolios poco densos,[2] matorrales,[2] vegetación ribereña,[9] praderas y prados,[15] cultivos de frutales[15] y áreas residenciales.[2][15] Generalmente, evita los bosques tupidos y sin claros,[2][10] pero prospera en aquellos más fragmentados.[30] En Kansas, un censo llevado a cabo entre 1974 y 1988 reveló que había 6 tordos cabecicafé por km² en las praderas de pastos altos, pero tan sólo 1 por km² en los humedales adyacentes.[4]
Los tordos cabecicafé son capaces de explotar los ambientes modificados por el hombre particularmente bien debido a la gran variedad de alimentos que consumen y su adaptabilidad a nuevos hábitats.[24] Para alimentarse, necesitan áreas con vegetación baja.[35] Prefieren las zonas en las que haya ganado en donde pueden conseguir tanto insectos como granos, pero también aprovechan desperdicios que encuentren en cámpings, áreas de pícnic, etcétera. Debido a que no cuidan de sus polluelos, las áreas de alimentación pueden estar alejadas de las de reproducción, lo que le permite a las hembras de esta especie explotar distintos hábitats sobre grandes distancias.[24] Sin embargo, las zonas en las se alimentan y depositan sus huevos también pueden superponerse, particularmente en el este de su área de distribución.[49][50]
Los sitios en los que posarse constituyen un elemento importante dentro de los hábitats de los tordos cabecicafé, puesto que los machos cantan y se exhiben desde allí y las hembras los utilizan para buscar huéspedes para sus huevos. Estos sitios incluyen árboles, arbustos y otras estructuras que excedan la altura promedio de la vegetación circundante. En Alberta, Biermann y otros (1987) observaron individuos posados en árboles de hasta 4 metros de altura; no así en áreas sin árboles dominadas por el arbusto Artemisia tridentata.[35]
En Wisconsin, de 1375 avistamientos entre 1995 y 2000 en los que se registró el tipo de hábitat en el que fue observado, el 25% se dio en zonas de meseta con arbustos de madera dura (particularmente setos) o arbustos mixtos, 23% en áreas urbanas, 19,5% en zonas de meseta con bosques de madera dura (en especial robles) o bosques mixtos, y 14% en áreas abiertas de meseta.[49] En Míchigan, un tercio de las observaciones entre 1983 y 1988 se produjeron en hábitats residenciales, al costado de caminos y rutas y en setos.[49][51] En un estudio llevado a cabo en Illinois, Robinson y otros (1999) descubrieron que había menos hembras de tordo cabecicafé en los pastizales (alrededor de 1,25) por cada 100 huéspedes de especies receptivas para con sus huevos que en los bosques (3,75), sabanas (12,5) y matorrales (5).[35]
La abundancia de tordos cabecicafé puede verse influida por las características de la vegetación, tal como lo han comprobado numerosos estudios realizados en distintos estados del norte de las Grandes Llanuras. En Nebraska, el número de ejemplares estaba positivamente relacionado con la altura de la vegetación (King y Savidge, 1995). En Minnesota, Montana, Dakota del Norte y Dakota del Sur, la densidad de su población era menor en áreas cubiertas con césped y legumbres (Johnson y Schwartz, 1993 a). En praderas de pasto mixto quemadas en el noroeste de Dakota del Norte, eran más abundantes en presencia de plantas herbáceas, vegetación viva y asociaciones del arbusto Symphoricarpos occidentalis y especies de césped tales como Elytrigia repens y Bromus inermis (Madden, 1996).[35]
En los campos de pasturas de Dakota del Norte surcentral y noroccidental existía una mayor cantidad de ejemplares en las formaciones vegetales dominadas por una mezcla de pasto azul de Kentucky (Poa pratensis) y especies nativas de césped. Su abundancia estaba negativamente asociada a la densidad de los arbustos y a un lecho de la planta licófita Selaginella densa, y era baja en las áreas dominadas únicamente por especies nativas de césped. Asimismo, el principal elemento determinante de su abundancia era una escasa obstrucción visual, ligada a la altura y la densidad de la vegetación (Schneider, 1998).[35]
En Colorado, Montana, Nebraska, Dakota del Norte, Dakota del Sur y Wyoming, altas densidades de tordos cabecicafé se encontraban en zonas moderadamente utilizadas como pasturas en las que hubiera pasto azul de Kentucky y la planta herbácea Artemisia ludoviciana (Kantrud y Kologiski, 1982). En el centro de Dakota del Norte, había una mayor cantidad de ellos en áreas cubiertas en un 30 – 80% de Symphoricarpos occidentalis y Elaeagnus commutata que en áreas cubiertas por arbustos en menos de un 10% (Arnold y Higgins, 1986). En Iowa su número a los costados de rutas y caminos era inversamente proporcional a la altura de la vegetación y a la densidad vertical de la misma (Camp y Best, 1993). En hábitats ribereños, la densidad de su población estaba negativamente relacionada con la densidad de los árboles y positivamente vinculada a los árboles pequeños y a la estratificación vertical de la vegetación de menos de 3 metros (Stauffer y Best, 1980). Young y Hutto (1999) se encontraron con que en Montana y Idaho eran más comunes en aéreas abiertas, como pastizales y terrenos agrícolas, y en áreas ribereñas que en los bosques.[35]
La distancia a los terrenos agrícolas, como prados, tiene una fuerte influencia sobre la presencia de los tordos cabecicafé (Goguen y Mathews, 1999). En Nuevo México, su abundancia y tasas de parasitismo en nidos de víreo plomizo (Vireo plumbeus) se reducían con la distancia de los prados activamente utilizados como pasturas para los animales, desde un 81% de 58 nidos en esos prados a 33% de 24 nidos ubicados a entre 8 y 12 km de ellos (Goguen y Mathews, 2000). En un área agrícola de Misuri, la densidad de tordos cabecicafé alimentándose era mayor en feedlots, seguido por césped corto (2 a 20 cm) usado como pasturas, césped largo (5 a 30 cm) empleado para el mismo fin y hábitats no utilizados como pasturas, siendo estos últimos césped cortado, campos de heno con pasto de entre 2 y 10 cm y campos de heno sin cortar con pasto de más de 30 cm (Morris, 1996; Morris y Thompson, 1998). Las tasas de parasitismo eran más altas en un prado que había sido poco utilizado como pastura (58% de 93 nidos) que en un área silvestre que no había sido empleada para tal fin (22% de 139 nidos) en Manitoba (Knapton, 1978). El número de tordos cabecicafé en el prado se redujo después de que dejara de ser empleado como pastura.[35]
La topografía era un importante elemento en la determinación de su abundancia en el oeste de Montana —más aún que la cantidad de aves hospedadoras y el tipo de vegetación—, puesto que se les hallaba más frecuentemente sobre un relieve llano que en uno escarpado, en parte debido a que los cañones estaban más alejados de los terrenos agrícolas y la densidad de huéspedes es menor allí que en áreas llanas (Tewksbury y otros, 1999). Young y Hutto (1999) informaron que los tordos cabecicafé en Montana y Idaho eran menos proclives a encontrarse en pastizales de gran altitud; no fueron hallados por encima de los 2.318 m sobre el nivel del mar. En otros lugares, sin embargo, han sido avistados en altitudes aún mayores, como en Colorado —a 2.895 m (Hanka, 1985)— y en California, en donde el 41% de los 114 sitios en los que fueron vistos por Rothstein y otros (1980) se encontraban por encima de los 2.400 m sobre el nivel del mar.[35]
Dentro de la Columbia Británica, el tordo cabecicafé es avistado generalmente en altitudes bajas tanto sobre la costa como en el interior. Sobre la costa, la mayor parte de los registros son de las tierras bajas de la depresión de Georgia, aunque han sido observados acompañando al uapití de Roosevelt (Cervus canadensis roosevelti) a altitudes de 1.370 m (Green Mountain, cerca de Nanaimo). A fines del verano, los jóvenes se alimentan en las crestas alpinas. En el interior de la provincia, el tordo cabecicafé ha sido encontrado a altitudes de entre 460 y 2440 m (al sur del lago Tatlayoko) y los juveniles independientes son frecuentemente vistos en praderas alpinas. Se cree que la conquista de estas altitudes elevadas en la Columbia Británica es relativamente reciente, al igual que la expansión latitudinal documentada por Rothstein y otros (1980) en la Sierra Nevada y la registrada por Hanka (1985) en Colorado. En ambos casos, el fenómeno se atribuyó a la alteración del hábitat causada por el intensivo consumo de la vegetación del terreno por parte del ganado.[29]
En la Columbia Británica, el tordo cabecicafé ha sido documentado parasitando nidos a altitudes de entre casi el nivel del mar y los 335 m en la costa y entre los 280 y los 1600 m en el interior (Fonnesbeck, 1998). En todas las ecoprovincias es más abundante en altitudes bajas.[29]
El tordo cabecicafé rara vez salta sobre el suelo, prefiriendo caminar o correr.[15][19] Bate sus alas constantemente cuando vuela;[10] de acuerdo con la descripción de Arthur Cleveland Bent, su vuelo pareciera ser más bien inestable, similar al del tordo sargento (Agelaius phoeniceus).[19] Los machos suelen posarse erguidos sobre las copas de los árboles al tiempo que reproducen silbidos y se congregan sobre el césped para pavonearse y exhibirse ante las hembras, mientras que éstas a menudo merodean por los márgenes de los bosques en busca de nidos.[10][34] Se trata de aves ruidosas capaces de vocalizar diferentes sonidos.[10] Mientras cantan, los machos frecuentemente inflan las plumas de su dorso y pecho, levantan sus alas, despliegan las plumas de su cola y se inclinan hacia adelante; a veces hacen esto en grupo.[10] Cuando no están exhibiéndose o alimentándose en el campo, se posan en ramas altas y prominentes.[10] Es posible encontrarlos en jardines hogareños, más aún si se ha esparcido semillas para aves sobre el suelo.[10] Es una especie altamente gregaria en todas las estaciones.[19]
Debido a que los tordos cabecicafé no cuidan de sus polluelos, sus dos principales actividades durante la temporada reproductiva —la alimentación y la búsqueda de nidos— pueden llevarse a cabo en sitios distintos.[16] Consecuentemente, pueden ocupar hábitats que satisfagan sólo una de esas necesidades y volar regularmente hasta 7 km entre las áreas de alimentación y las de búsqueda de nidos (Rothstein y otros, 1984).[16][52] En el sur de Illinois y el centro de Misuri, los tordos cabecicafé que buscaba nidos en los bosques se trasladaban entre 0,1 y 4,0 km para alimentarse en pasturas con ganado, feedlots de cerdos, caballos y vacas, costados de caminos con el césped corto, jardines, campos recientemente arados y sembrados, campings, costados de caminos con grava, comederos de aves y caminos de ripio.[16] Según Stephen I. Rothstein y otros (1980), los tordos cabecicafé a veces no se mueven de sus áreas de reproducción, si las mismas les ofrecen la oportunidad de alimentarse y dormir allí mismo.[35]
En el este de la Sierra Nevada, el tordo cabecicafé se reproduce y se alimenta en sitios casi totalmente distintos. Las cinco hembras y cuatro de los ocho machos equipados con radiotransmisores estudiados por Stephen I. Rothstein, Jared Verner y Ernest Stevens a principios de la década de 1980 pasaban las primeras horas de la mañana en bosques abundantes en huéspedes y luego se trasladaban entre 2,1 y 6,7 km hasta los lugares de alimentación como corrales de caballos y zonas residenciales con comederos para aves. Los cuatro machos que no volaron esas grandes distancias para alimentarse, que tenían sólo un año de edad y posiblemente estaban socialmente subordinados, también mostraban una gran movilidad pero no ocupaban las mismas áreas reproductivas cada mañana. Las áreas matutinas de reproducción de las aves que se desplazaban, consideradas individualmente, tenían una extensión promedio de 68 hectáreas y la suma de sus áreas de reproducción y las áreas en las que se alimentaban por la tarde ocupaban un promedio de 442 hectáreas. Estas cifras se encuentran entre las más altas documentadas entre los paseriformes e igualan las de algunas aves de presa. Los patrones de traslación de los tordos cabecicafé implican un cambio radical entre un comportamiento bastante antisocial durante la mañana y otro extremadamente sociable por la tarde. A diferencia de ictéridos no parasíticos que se alejan desde un sitio reproductivo central (su nido) para alimentarse, estas aves hacen lo contrario, apartándose de los sitios centrales de alimentación para reproducirse en otros lugares.[52]
El tordo cabecicafé es un ave migratoria de corta distancia dentro de América del norte.[4] Puede haber diferencias entre las distancias recorridas por los adultos y los juveniles.[53] En el noreste, la mayoría de los individuos se desplaza unos 800 a 850 km entre las áreas de reproducción y las regiones en las que pasan el invierno.[4][6] Según la National Geographic, mayormente vuelan hacia el norte entre mediados de marzo y mediados de abril y hacia el sur entre fines de julio y octubre.[20] De acuerdo con Batts (1958), Bent (1965), Knapton (1979) y Johnsgard (1980), arriban al norte de los Estados Unidos desde inicios de abril a comienzos de mayo y parten entre agosto y noviembre.[35] Llegan a Connecticut en marzo y, aunque algunos pocos pasan allí el invierno, la gran mayoría migra a fines de septiembre.[25] En la Columbia Británica, el mayor número de tordos cabecicafé en invierno se encuentra en la ecoprovincia de la depresión de Georgia (este de la isla de Vancouver y extremo sudoeste de la Columbia Británica continental), y en verano, en las ecoprovincias interior meridional (centro del sur de la provincia) y montañas meridionales del interior (sudeste).[29]
Viajan durante el día, con frecuencia como parte de grandes bandadas compuestas por diversas especies: tordos sargento (Agelaius phoeniceus), zanates norteños (Quiscalus quiscula), estorninos pintos (Sturnus vulgaris) y, más raramente, tordos canadienses (Euphagus carolinus), tordos ojo amarillo (Euphagus cyanocephalus) y zorzales pechirrojos (Turdus migratorius).[4][6] Típicamente, los machos llegan antes que las hembras a las zonas en las que se reproducen.[33] Según una información publicada en 1958, la migración primaveral en Maryland y el Distrito de Columbia ocurre entre el 5 de febrero y el 25 de abril, con un pico de actividad entre el 10 de marzo y el 10 de abril.[4][54] En otoño, sobre las laderas occidentales de la Sierra Nevada, los juveniles comienzan a formar bandadas a medida que adquieren independencia. Según datos publicados aquel mismo año, los primeros juveniles independientes aparecieron el 14 de julio. En la misma área, todos los adultos partieron entre el 17 de julio y el 21 de julio. En Maryland y el Distrito de Columbia, la migración de otoño se extiende desde el 15 de agosto hasta el 10 de diciembre, con su apogeo entre el 25 de septiembre y el 1 de noviembre.[4][54]
Según Arthur Cleveland Bent (1958), los tordos cabecicafé orientales no viajan mucho en su migración de primavera, dejando los estados sureños durante marzo para alcanzar las partes septentrionales de su área de reproducción en las primeras dos semanas de abril y a veces antes del final de marzo. Herbert Friedmann (1929) escribió que comúnmente migraban en compañía de tordos sargento (Agelaius phoeniceus), tordos canadienses (Euphagus carolinus) y zanates norteños (Quiscalus quiscula), mientras que se relacionaban con menor frecuencia con praderos orientales (Sturnella magna) y zorzales pechirrojos (Turdus migratorius) en el este y tordos ojo amarillo (Euphagus cyanocephalus) y tordos cabeciamarillos (Xanthocephalus xanthocephalus) en el oeste. Los juveniles llegan a las áreas de reproducción después que los adultos. Bent afirmó que la migración otoñal comienza en septiembre, pero tiene lugar principalmente en octubre, con algunos individuos quedando aún en su área de distribución estival bien entrado noviembre.[19]
Aunque los machos con pareja y las hembras se dispersan en sus territorios reproductivos, suelen encontrarse en las cercanías bandadas de individuos sin pareja o promiscuos con los cuales las aves reproductivas se relacionan hasta cierto punto. Herbert Friedmann (1929) nunca los documentó peleando, pero la Sra. Nice (1937) los vio reñir en cinco oportunidades “en ocasión de discrepancias entre los machos durante eventos de cortejo comunal.”[19]
Tan pronto como finaliza la puesta de huevos, los tordos cabecicafé comienzan a agruparse en grandes bandadas para alimentarse en los campos y prados. Los jóvenes se suman a estos grupos cuando se independizan de sus padres adoptivos. Elon H. Eaton (1914) estimó que la bandada promedio en otoño sería de entre 50 y 200 aves.[19]
En algunos lugares —particularmente en el oeste—[22] los juveniles pueden no interactuar en ningún momento con los adultos durante su primer año de vida, mientras que en otros sitios se unen a bandadas de otros tordos cabecicafé mientras aquellos aún se encuentran en los días finales de la temporada reproductiva y permanecen a su lado durante un año entero.[53] En áreas recientemente colonizadas, existe una mayor fluidez social entre los individuos de esta especie, es decir, más ejemplares se suman o se separan de las bandadas, mientras que en poblaciones más antiguas se aprecia una mayor estabilidad social.[22] Se han registrado bandadas exclusivamente de juveniles, únicamente de hembras y mixtas.[53]
Fuera de la época de reproducción, duermen en compañía de varias especies de ictéridos en grupos de más de 100 mil aves.[10] Los tordos sargento (Agelaius phoeniceus), zanates norteños (Quiscalus quiscula), tordos cabecicafé y estorninos pintos (Sturnus vulgaris) pasan la noche en grandes concentraciones a finales del verano y en otoño.[55] En Kentucky, estas asociaciones mixtas pueden superar los 5 millones de individuos, de los cuales un 2 a un 5% son generalmente tordos cabecicafé.[4][10] En Oklahoma, las bandadas de descanso tienen su auge en noviembre, con 250 a 900 mil aves.[4][6]
En ocasiones, los tordos cabecicafé pasan la noche acompañados de golondrinas.[19] Milton B. Trautman (1940) documentó que algunos tordos cabecicafé que pasaban el invierno en Ohio a veces se asociaban con gorriones comunes (Passer domesticus).[19] Durante el invierno, es posible verlos junto a tordos tricolores (Agelaius tricolor) en el delta de Sacramento-San Joaquín y la zona central de la costa de California.[56] Edward Howe Forbush (1927), por otra parte, manifestó que “en Nueva Inglaterra los tordos cabeciafé generalmente duermen entre ellos; con frecuencia eligen coníferas de tronco grueso u otras arboledas en las que pasan la noche en grandes números. Otro lugar de descanso predilecto es entre el pasto y los juncos en amplios prados.”[19]
John E. Galley le envió a Arthur Cleveland Bent sus anotaciones con respecto su estudio sobre una gran bandada invernal de descanso de tordos cabecicafé y estorninos en Midland (Texas). En el momento de mayor abundancia, estimó que el sitio en el que estas aves descansaban agruparía “entre 10.500 y 11.000 individuos, de los cuales 2.000 o 2.500 eran tordos cabecicafé.” Dormían en olmos chinos (Ulmus parvifolia) alrededor del palacio de justicia de la ciudad. “Los estorninos se congregaban en las ramas más altas, los tordos cabecicafé debajo de ellos.”[19]
Las vocalizaciones son el componente básico del sistema de comunicación de los tordos cabecicafé.[53] Al igual que en otros paseriformes, cumplen un rol importante durante la época de reproducción.[57] Son utilizadas entre los machos en lo que podría denominarse "duelos vocales" que sirven para establecer jerarquías de dominancia dentro de un grupo.[53] Asimismo, cantar persistentemente les es necesario para conseguir una compañera con la que aparearse.[53] Si bien también cantan en los meses de invierno, los machos hacen mayor uso de estas vocalizaciones, fundamentales para atraer a las hembras, como parte del cortejo y durante la temporada reproductiva.[57] Aretas A. Saunders describió:
Algunos de los sonidos del tordo cabecicafé son claramente estacionales, emitidos en su mayoría, sino exclusivamente, por el macho y por lo tanto deberían ser considerados canciones, aunque no sean muy agradables al oído. La más común de ellas consiste en una nota prolongada, aguda y chillona, seguida de otras dos o tres notas más cortas y graves y generalmente sibilantes. Podría ser transcripta como wheeeee tsitsitsi. (…) La primera nota puede estar por completo dentro de un mismo tono o elevarse ligeramente. Una alternativa no inusual consiste en una primera nota procedida por una variación descendente que es explosiva y sibilante al principio; suena wheeeee tseeya y recuerda bastante a un estornudo.Durante el cortejo, cuando el macho está inclinándose y desplegando sus alas y cola, produce otro tipo de canción, algo similar a la descripta para el zanate bajo circunstancias semejantes, pero por lo general sube abruptamente desde un tono acústico grave a uno agudo: dos o tres notas bajas y luego unas pocas altas y chillonas. Las notas graves no son ásperas, sino gorgoteantes. Suena como glub-glub-kee-he-heek. (…)
El período en el que estas canciones son reproducidas se extiende entre el arribo de las aves y principios de julio, cuando termina la puesta de huevos y las aves se congregan en bandadas para alimentarse en los campos durante el resto del verano. Las notas de sus llamados incluyen un corto chuck, un preeah poco definido y un traqueteo fuerte y áspero.[19]
El botánico y ornitólogo Eugene Pintard Bicknell (1884) afirmó:
Parece no haber regularidad en su canto en el otoño; pero he escuchado algunas canciones imperfectas o incompletas en distintas oportunidades en el mes siguiente a mediados de septiembre. A veces, en otoño, cuando los tordos cabecicafé se congregan en pequeñas bandadas, se vuelven parladores y la emisión combinada de sus notas graves produce el sonido de un gorjeo suave.[19]
Su dieta está compuesta de semillas, frutos, bayas, insectos y otros invertebrados.[13] Prefieren las semillas de hierbas a los granos de cultivo.[10] Durante el verano, las semillas representan alrededor de la mitad de su dieta, mientras que la otra mitad consiste en insectos y otros invertebrados. Las semillas y los granos residuales componen más del 90% de su alimentación invernal.[33]
Se alimentan sobre el suelo,[15] en grupos mixtos de ictéridos y estorninos.[10] Mientras caminan sobre la tierra alimentándose, levantan la cola por encima de su dorso.[20][58] Frecuentemente siguen a caballos, vacas y bisontes para atrapar los insectos que estos levantan al caminar; de allí, los nombres de "vaquero cabecicafé" y "vaquero de cabeza castaña".[19] Buscan alimento entre las cabezas y las patas del ganado, sin espantarse.[19] En ocasiones también se posan sobre el lomo de estos mamíferos y extraen las garrapatas e insectos que encuentren sobre ellos. Algunos autores de antaño afirmaron que buscaban gusanos intestinales entre los excrementos de dichos animales; sin embargo, según Arthur Cleveland Bent, esto no fue respaldado por los análisis estomacales.[19] Las hembras necesitan grandes cantidades de calcio para depositar sus numerosos huevos, el cual consiguen ingiriendo las conchas de caracoles y a veces las cáscaras de los huevos del ave hospedadora cuyo nido parasitan, particularmente durante la temporada reproductiva.[10][33]
Beal (1900) escribió sobre los contenidos estomacales de 544 tordos cabecicafé, obtenidos de 20 diferentes estados durante todos los meses del año y examinados por la Biological Survey:
Los alimentos hallados en estos estómagos fueron clasificados de la siguiente manera: materia animal (22,3%) y materia vegetal (77,7%). (...) Los alimentos de origen animal consisten casi completamente en insectos y arañas, siendo unos pocos caracoles la excepción. Los insectos comprenden avispas y hormigas (Hymenoptera), hemípteros, algunas moscas (Diptera), escarabajos (Coleoptera), saltamontes (Orthoptera) y orugas (Lepidoptera). (…) Los saltamontes parecen ser el alimento animal favorito de los tordos cabecicafé y componen la mitad de su dieta insectívora o un 11% del total. (…) Los alimentos de origen vegetal del tordo cabecicafé exceden a los de origen animal tanto en calidad como en variedad. Cuando examina el suelo en cascos de estancia y caminos evidentemente busca semillas esparcidas más que insectos, aunque probablemente tomen estos últimos cuando los encuentran.(…) [Consume también] semillas duras de pastos y hierbas, con pocos indicios de consumo de pulpa de fruta u otro tipo de materia vegetal suave.[19]
Se encontraron granos de maíz en 56 estómagos, de trigo en 20, de avenas en 102 (…), mientras que se hallaron semillas de ambrosías en 176 estómagos, de Echinochloa[59] en 265 y de Panicum en 133. Los granos constituían un 16,5% —alrededor de un sexto— de su dieta anual y probablemente la mitad de estos sean granos residuales.[19] Beal afirmó:
Resumiendo los resultados de la investigación, los siguientes puntos pueden considerarse bastante sólidos: 1) Un 20% del alimento del tordo cabecicafé consiste en insectos, los cuales son perjudiciales, o bien, molestos. 2) Un 16% es grano, cuyo consumo podría considerarse una pérdida, aunque es casi seguro que la mitad de éste sea grano residual. 3) Más del 50% consiste en semillas de hierbas perjudiciales, cuya eliminación es beneficiosa para el productor. 4) Prácticamente no comen fruta.[19]
B. H. Warren (1890) aseveró que los tordos cabecicafé consumen moras, cerezas silvestres, Vitis aestivalis y otras bayas. E. R. Kalmbach (1914) lo incluyó entre las aves que comen Hypera postica, un escarabajo curculiónido que afecta los cultivos de alfalfa; según él, desde el 1 de mayo hasta mediados de julio, el curculionoideo constituye más de la mitad de su ingesta. El zoólogo Arthur Holmes Howell (1907) afirmó que se alimentaba del Anthonomus grandis, otro curculiónido nocivo para la agricultura, que daña los cultivos de algodón. Hervey Brackbill le escribió lo siguiente a Arthur Cleveland Bent: “Una tarde me topé con una hembra de tordo cabecicafé comiendo semillas de diente de león directamente de la estructura que las sostenía. Debió haber encontrado dificultoso alimentarse de ese tallo recto, por que lo después de que hubiera presenciado unos pocos bocados suyos, lo sujetó sobre el suelo con una de sus patas y terminó de comer de esa manera.”[19]
El rasgo más característico de esta ave con respecto a su reproducción es el hecho de que practica el parasitismo de puesta. La hembra deposita sus huevos en los nidos de otras aves —típicamente, paseriformes pequeños—,[2] en particular en aquellos en forma de taza.[24] Los machos alcanzan la madurez sexual al año, pero rara vez se aparean hasta los dos años.[4][6] Las hembras se reproducen ya al año de edad.[4][6] Al igual que en otros paseriformes, las vocalizaciones cumplen un rol importante durante la época de reproducción. Si bien también cantan en los meses de invierno, los machos hacen mayor uso de estas vocalizaciones, fundamentales para atraer a las hembras, como parte del cortejo y durante la temporada reproductiva.[57]
La temporada reproductiva inicia en abril, culmina en mayo, comienza a declinar en junio y continúa de manera esporádica en julio.[2] Según Ortega (1998), generalmente se extiende desde comienzos de mayo a fines de julio, un período que se superpone con la época de reproducción de numerosas aves norteamericanas de los pastizales (Stewart, 1975).[35] En Dakota del Norte, de acuerdo con Stewart (1975), se prolonga hasta mediados de agosto, pero tiene su auge entre inicios de mayo y mediados de julio.[35] En Connecticut, es posible ver adultos cortejando en marzo e inicios de abril y las hembras comienzan a depositar sus huevos a mediados de mayo.[25] Según información de 1958, los tordos cabecicafé ponen sus huevos en Maryland y el Distrito de Columbia desde fines de abril a fines de julio (siendo las fechas extremas el 24 de abril y el 28 de julio), particularmente desde comienzos de mayo hasta comienzos de julio.[4][54] Según un estudio publicado en 1993, en Misuri se han encontrado huevos de esta especie en nidos ajenos desde mediados de abril hasta mediados de julio.[4][6]
Numerosos estudios han constatado una cierta tendencia a regresar una y otra vez a las mismas zonas de reproducción tanto por parte de los machos como de las hembras. En Manitoba (Canadá), el 64% de 337 machos marcados y el 46% de 173 hembras marcadas exhibían un comportamiento de fidelidad hacia los sitios en los que se reproducían (Woolfenden y otros, 2001). Shake y Mattsson (1975) se encontraron con que el 40% de 119 machos y el 9% de 81 hembras marcados en Míchigan centro septentrional regresaron a un radio de 4,8 km desde el punto en el que habían sido identificados el año anterior. En un estudio llevado a cabo en Illinois, Raim (2000) descubrió que el 47% de 79 sitios de reproducción utilizados por hembras con marcas de colores en junio de un año volvía a ser usado por las mismas aves al año siguiente.[35]
En el noreste de Arkansas, se descubrieron egagrópilas de búho campestre (Asio flammeus) que contenían restos de tordos cabecicafé.[4][60] Los predadores de los polluelos incluyen la culebra corredora constrictor (Coluber constictor), la víbora ratonera (Elaphe obsoleta) y el arrendajo azul (Cyanocitta cristata). Estas aves a veces atacan conjuntamente a los búhos cornudos (Bubo virginianus), un potencial predador tanto para los adultos como para los jóvenes. Los ectoparásitos, los helmintos y las bacterias infecciosas son otros factores de mortalidad.[4][6]
De acuerdo con Arthur Cleveland Bent (1958), mientras descansan son presas del visón americano (Neovison vison), las comadrejas (Mustela spp.) y los búhos, y durante el día son atacados por halcones (Falco spp.) y otros falconiformes. Harold S. Peters (1936) lista un piojo, dos moscas, una garrapata y otras dos especies de ácaros como ectoparásitos del tordo cabecicafé oriental.[19]
Los químicos utilizados para controlar los insectos pueden matar a los tordos cabecicafé. En Nuevo México, el toxafeno aplicado a una superficie de 71.600 hectáreas de pradera de pasto corto causó una disminución en el número de estas aves (McEwen y otros, 1972). El diazinón rociado sobre el césped y sobre una cancha de béisbol en Connecticut mató a docenas de tordos cabecicafé (Anderson y Glowa, 1985).[35]
De acuerdo con Arthur Cleveland Bent, sus hábitos alimenticios son decididamente más beneficiosos que perjudiciales, provocando muy poco daño a los cultivos y eliminando muchos insectos nocivos. Se alimentan, por ejemplo, de Anthonomus grandis e Hypera postica, dos especies de curculiónidos que afectan el algodón y la alfalfa respectivamente. La principal causa de su impopularidad yace en el daño que produce a través de su comportamiento parasítico, el cual indudablemente interfiere con la crianza de una gran cantidad de pequeñas aves insectívoras.[19] Beal (1900) escribió al respecto:
Cuando un único polluelo de tordo cabecicafé reemplaza una nidada de cuatro aves, se produce, obviamente, una pérdida clara; pero, como ya se ha dicho, debe atribuírsele una gran importancia económica debido a sus hábitos alimenticios, y hay que recordar que en la mayoría de los casos las aves eliminadas son mucho más pequeñas que el intruso y por lo tanto el efecto de su alimentación es menor, y que a menudo se depositan dos o tres huevos de tordo cabecicafé en un mismo nido.[19]
De 215 especies neotropicales migratorias, Rodenhouse y otros (1992) listan al tordo cabecicafé entre las menos de diez que causan un daño significativo a los cultivos sobre amplias áreas geográficas.[61]
El problema del parasitismo del tordo cabecicafé, especialmente en los hábitats ribereños, ha sido documentado.[23] Debido a que puede tener un impacto significativo sobre el éxito reproductivo de otras aves, muchas han aprendido a reconocer este peligro y actúan agresivamente hacia el tordo cabecicafé cuando este se acerca a sus territorios.[15] La fragmentación de los bosques en América del norte expandió su hábitat y redujo —y en muchos lugares, eliminó— los hábitats de vegetación densa en los que esta especie no penetraba.[15] Como consecuencia, un cierto número de aves del bosque sufre una amenaza progresiva de parasitismo de puesta.[15][30] A diferencia de las moradoras de las Grandes Llanuras, estas nuevas víctimas no evolucionaron conjuntamente con el tordo cabecicafé y, por esta razón, no cuentan con las defensas naturales necesarias para hacer frente a su parasitismo y se vuelven extremadamente vulnerables en presencia de estos parásitos de puesta.[18][30] Se le ha responsabilizado por la disminución en las poblaciones de varios paseriformes.[2] Por otro lado, Martin (1992) sostuvo que en la mayoría de los lugares los efectos de la depredación en los nidos sobre la dinámica poblacional de los huéspedes del tordo cabecicafé superan ampliamente las repercusiones del parasitismo de puesta.[16]
Aunque algunas especies pueden volver a anidar y, por lo tanto, su éxito reproductivo no se ve tan afectado por el parasitismo de puesta, otras aves cuyas temporadas de reproducción son más abreviadas no son capaces de hacerlo y corren mayor riesgo a causa del tordo cabecicafé. Sin embargo, parte de este impacto ambiental es controversial y un estudio sobre la magnitud de los daños del tordo cabecicafé en las poblaciones de aves norteamericanas argumentó que los conservacionistas y el público en general tienden a magnificar las implicaciones de esta peculiar estrategia reproductiva como causa importante del decrecimiento de las poblaciones de aves.[2]
En general, las poblaciones de huéspedes deben producir 2,0 – 2,5 jóvenes al año por pareja para mantener una tasa de crecimiento poblacional positiva, asumiendo que la supervivencia anual sea de un 40 – 60% para los adultos y 20 – 35% para los jóvenes. Los niveles de parasitismo de puesta que pueden ser tolerados manteniendo un crecimiento poblacional positivo varían entre las distintas aves hospedadoras. Las especies con altos niveles de depredación en sus nidos, una baja proporción de abandono de los nidos parasitados, períodos de incubación prolongados y temporadas reproductivas breves en relación al período de incubación sólo pueden soportar una frecuencia parasítica menor. Contrariamente, las especies con escasa depredación en sus nidos, un alto porcentaje de abandono de los nidos vulnerados —por ejemplo: el verdín de las praderas (Dendroica discolor); Nolan, 1978—, períodos de incubación reducidos y épocas de cría más largas podrían ser más resistentes a la amenaza del parasitismo.[16]
El parasitismo de puesta del tordo cabecicafé representa efectivamente una amenaza para diversos paseriformes neotropicales migratorios con áreas de distribución restringidas.[16] Robinson y otros (1989) incluyen entre las aves amenazadas por el parasitismo al chipe de Kirtland (Dendroica kirtlandii; Walkinshaw, 1983), una subespecie de víreo de Bell (Vireo bellii pusillus; Franzreb, 1989), otra de mosquerito saucero (Empidonax traillii extimus; Unitt, 1987; Brown, 1988), al víreo gorra negra (Vireo atricapilla; Grzybowski y otros, 1986) y al chipe mejillas doradas (Dendroica chrysoparia).[16] Cabe destacar que para el mosquerito saucero, así como para la mayoría de las especies en peligro afectadas por el parasitismo del tordo cabecicafé, existe una interacción compleja entre los efectos directos resultantes de la pérdida de su hábitat y los efectos indirectos derivados del parasitismo de puesta.[4][31]
Las pequeñas poblaciones de estas aves son frecuentemente parasitadas, lo que condujo a la implementación de programas de captura de tordos cabecicafé en áreas específicas de reproducción en donde otras especies están amenazadas.[15] Los huéspedes con áreas de distribución más amplias son menos vulnerables debido a que las poblaciones severamente parasitadas pueden ser restauradas con inmigrantes procedentes de otras regiones en donde el parasitismo sea menor.[16]
En una investigación llevada a cabo en el Sierra National Forest (California) entre 1980 y 1981 (Verner y Ritter, 1983), la abundancia relativa de víreos gorjeadores (Vireo gilvus) estaba negativamente relacionada con la de tordos cabecicafé, lo cual respalda los resultados de estudios anteriores que habían encontrado altas tasas de parasitismo de puesta en los nidos de esta especie en la Sierra Nevada. Sin embargo, debido a que los tordos cabecicafé son raros o se encuentran ausentes en muchos de los principales tipos de hábitats y en áreas alejadas de fuentes de alimento vinculadas a las actividades humanas, Verner y Ritter pusieron en duda la posibilidad de que alguna otra especie en la Sierra Nevada se viera amenazada por el parasitismo. Aun así, los autores destacaron la necesidad de un monitoreo periódico debido a la creciente presencia humana en las montañas.[32]
Gaines (1974), en un estudio de la avifauna ribereña del Valle de Sacramento (California), sugirió que los tordos cabecicafé habían constituido un factor relevante en las significativas disminuciones poblacionales de varias especies de paseriformes en ese lugar durante los cuarenta años anteriores. El víreo de Bell (Vireo bellii) ha desaparecido aparentemente de California central y el parasitismo del tordo cabecicafé es considerado una de las principales causas de esto (Games, 1974; Goldwasser y otros, 1980).[32]
Mayfield (1960) identificó una tasa de parasitismo del 55% en los nidos del chipe de Kirtland (Dendroica kirtlandii).[62] En 1971, el mismo autor pronosticó la extinción de la especie para 1980 si el tordo cabecicafé no era controlado.[63][64] Gracias a un programa extensivo iniciado en 1972, la población de esta ave se mantuvo estable durante unos veinte años aunque sin recuperarse, hasta que se registraron ligeros aumentos poblacionales en 1991 y 1992.[64] Conforme a dos estudios de 1993, es probable que dicho programa haya sido la clave para la estabilización de las poblaciones del chipe de Kirtland.[16][64]
En 1972, el Servicio de Pesca y Vida Silvestre de los Estados Unidos, en cooperación con el Servicio Forestal, el Departamento de Recursos Naturales de Míchigan y la Michigan Audubon Society, comenzó a controlar el número de tordos cabecicafé con trampas ubicadas en las áreas de nidificación del chipe de Kirtland en primavera y a comienzos del verano. Las trampas, que contenían mijo, agua y varios tordos cabecicafé vivos, eran revisadas a diario y los tordos cabecicafé capturados eran eliminados. El éxito reproductivo del chipe mejoró dramáticamente desde el inicio del programa y la tasa de parasitismo se redujo de un 69% en 1966 - 1971 a menos del 5%. La cantidad de polluelos de chipe por nido que lograban independizarse aumentó de menos de uno a casi tres.[17][65]
El víreo de Bell (Vireo bellii) construye nidos en forma de taza abierta, los cuales son muy susceptibles al parasitismo del tordo cabecicafé (Goldwasser y otros, 1980). La reacción del víreo puede ser tanto el abandono del nido como la aceptación de los huevos extraños (Barlow, 1962). Naturalmente, los nidos no parasitados son más exitosos. Laymon (1987) calculó las curvas de crecimiento poblacional de acuerdo con cuatro tasas parasíticas diferentes utilizando información de ocho estudios entre 1929 y 1980: 13%, la tasa más baja conocida; 30%, el promedio de las tres tasas más bajas; 48%, el promedio de los ocho estudios, y 69%, el promedio de las dos tasas más altas. Con una tasa de parasitismo de un 13%, una población de víreos de Bell de 10 hembras alcanzaría las 100 hembras en 6 años. Una población con una tasa de parasitismo del 30% necesitaría 37 años para llegar a las 100 hembras, mientras que tasas del 48% y 69% llevarían a la extinción en 18 y 8 años respectivamente. Así, las tasas superiores al 48% conducirían a la extinción en un reducido lapso de tiempo, mientras que las mayores al 30% repercutirían en una población inestable que podría extinguirse a causa de acontecimientos eventuales.[23]
La subespecie pusillus de víreo de Bell, otrora abundante en el Valle Central de California y otros sistemas fluviales de baja altitud en ese estado norteamericano y en el mexicano de Baja California, desapareció de la mayor parte de su área de distribución reproductiva debido al limitado éxito de su reproducción a causa del parasitismo del tordo cabecicafé y a la pérdida de su hábitat.[66] Además de en su distribución, el Vireo bellii pusillus también ha sufrido una tremenda disminución en su número de ejemplares desde la década de 1920 debido a la alteración de la vegetación ribereña y al parasitismo de puesta.[67] Los programas de control de estos parásitos de puesta en áreas ribereñas resultaron beneficiosos para su reproducción.[66]
En la Columbia Británica, las especies que pueden estar amenazadas por el parasitismo del tordo cabecicafé incluyen el mosquerito saucero (Empidonax traillii) y el víreo gorjeador (Vireo gilvus). El víreo, otrora común en el sur del valle de Okanagan, prácticamente desapareció del valle; su disminución parece haberse debido a una combinación de la fragmentación de su hábitat y el parasitismo, factores que están amenazando la supervivencia de otros paseriformes en la región (Smith y otros, 1998).[29]
Para algunos otros paseriformes, sin embargo, particularmente las víctimas más frecuentes del parasitismo del tordo cabecicafé, que son especies comunes y ampliamente distribuidas, existe poca evidencia de algún efecto nocivo en sus poblaciones. Por ejemplo, en una población de gorriones melódicos (Melospiza melodia) en Mandarte Island —una isla diminuta en el estrecho de Georgia, al sudeste de la isla de Vancouver—, las hembras cuyos nidos fueron parasitados al menos una vez durante la temporada reproductiva lograron criar tantos polluelos hasta que estos lograran la independencia como las hembras que no habían sufrido parasitismo alguno en sus nidos (Smith, 1981). La colonización de Mandarte Island por parte de una o dos hembras de tordo cabecicafé tuvo un impacto pequeño en el número de gorriones melódicos debido a la incompleta superposición de las temporadas de puesta de huevos de ambas especies, las multiplicidad de las nidadas del gorrión, su habilidad para criar a sus propios polluelos junto a los del tordo cabecicafé y su éxito reproductivo basado en la densidad de su población (Smith y Arcese, 1994).[29][68]
A pesar de estar legalmente protegido por el Migratory Bird Treaty Act,[4][69] los métodos de control directo incluyen el envenenamiento, los disparos con armas de fuego y la captura con trampas.[35] Sin embargo, las implicancias éticas de la erradicación de grandes números de tordos cabecicafé, una especie nativa, deben ser consideradas.[16] Entre los métodos de control indirecto se encuentran la preservación de amplias superficies de bosque,[70] la reforestación[23] y la eliminación de sus zonas de alimentación.[70]
Conocer en dónde se encuentran las áreas de alimentación locales es esencial para diseñar y predecir la efectividad de los esfuerzos por controlar su número (Rothstein y otros, 1987). La telemetría provee la mejor información sobre el uso de áreas de alimentación y de reproducción (Rothstein y otros, 1980 y 1984; F. Thompson, información no publicada), pero es cara —alrededor de 140 dólares por transmisor— y trabajosa. F. Thompson estimó que rastrear a 35 o 40 hembras con trasmisores con un equipo de tres personas durante un período de dos meses costaría entre 25.000 y 35.000 dólares anuales por sitio estudiado. Si la telemetría resulta demasiado costosa, los tordos cabecicafé pueden ser censados visitando potenciales sitios de alimentación, especialmente al mediodía y a la tarde. Si sus áreas de alimentación son reducidas, es más probable que la captura con trampas sea efectiva (Rothstein y otros, 1987). Existen ciertos indicios de que las hembras podrían descansar en conjunto incluso durante la temporada reproductiva en algunos lugares (F. Thompson, información no publicada), lo que se traduciría en mayores oportunidades para el control local.[16]
Una vez que se identificó la presencia de tordos cabecicafé en un área, deben llevarse a cabo estudios para determinar la tasa parasítica en las especies más vulnerables. El porcentaje de parasitismo puede ser estimado a partir de una muestra de nidos (Pease y Grzybowski) o la frecuencia relativa con la que los huéspedes son vistos alimentando a sus propios polluelos en comparación a los polluelos de tordo cabecicafé. Si el nivel de parasitismo es alto —mayor al 25% de los nidos—, es probable que la especie no rechace los huevos intrusos (Rothstein, 1975) y podría estar amenazada por las perturbaciones de esta ave.[16]
Según Laymon (1987), los disparos posiblemente sean más efectivos que las trampas en hábitats ribereños angostos. Durante la temporada reproductiva, tanto los machos como las hembras pueden ser atraídos al área de alcance de un arma utilizando grabaciones de una hembra (Rothstein, comunicación personal). El dispararles a las hembras de manera selectiva dejando a los machos desbalancearía su población. La atracción de los tordos cabecicafé por medio de llamados grabados saca provecho de un comportamiento natural vinculado a su reproducción, razón por la cual es improbable que existan ejemplares inmunes a este método, un problema que sí puede surgir con las trampas.[23]
La otra técnica de control directo frecuentemente utilizada consiste en su captura con trampas en invierno en feedlots y tambos, o bien durante la temporada reproductiva en las proximidades de los nidos de las especies amenazadas. Las jaulas de grandes dimensiones con tordos cabecicafé vivos en su interior haciendo las veces de señuelos han demostrado ser efectivas para atrapar estas aves (Crase y otros, 1972). Los tordos cabecicafé son particularmente vulnerables a este sistema debido a su tendencia a concentrarse en bandadas numerosas durante el invierno. Laymon (1987) sugiere que la captura con trampas fuera de la época de reproducción debe considerarse más seriamente en las áreas con poblaciones comprobadamente sedentarias debido a que en muchos casos se desconoce si los tordos cabecicafé que pasan el invierno en cierto lugar son los mismos que se reproducen allí; recomienda además el marcado de las aves para estudiar sus movimientos.[23]
En Arkansas, la 4-aminopiridina fue utilizada para matar a las aves que dañaban los cultivos, mezclando una parte de ese químico en nueve partes de alimento, lo que resultó en la muerte de 5.400 tordos cabecicafé y estorninos pintos (Sturnus vulgaris; Dolbeer, 1988). Sin embargo, la efectividad de la 4-aminopiridina fue a corto plazo, debido a que el número de aves se recuperó dentro de los 8 días.[35]
El empleo de trampas ha sido puesto en práctica exitosamente para proteger varias especies neotropicales migratorias con poblaciones pequeñas y áreas de distribución locales.[16] Los tordos cabecicafé han sido activamente capturados por agencias de recursos naturales en un esfuerzo por reducir su impacto sobre las poblaciones de víreo gorra negra (Vireo atricapilla) en Texas y chipe de Kirtland (Dendroica kirtlandii) en Míchigan.[25] Sin embargo, es poco probable que la captura con trampas sea efectiva sobre áreas amplias tales como bosques nacionales.[16]
Las dimensiones de las jaulas suelen variar entre los 2 x 2,5 x 1,5 m y los 5 x 5 x 2 m. Las de este último tamaño son utilizadas más a menudo para deshacerse de grandes cantidades de ictéridos en áreas con una importante concentración durante los meses de invierno. Pueden estar constituidas por distintos paneles que se ensamblen y desarmen fácilmente si existe la necesidad de trasladar las trampas. Los tordos cabecicafé son atraídos por señuelos —otros ejemplares de su especie vivos en el interior de las jaulas— y comida e ingresan a través de una entrada en forma de embudo o rendija. Las entradas en forma de rendija han sido, hasta cierto punto, más exitosas que los embudos en lo que se refiere a evitar el escape de las aves capturadas (D. Steed, comunicación personal). Las jaulas más grandes resultan más eficientes que las de menor tamaño (Hesteberg y otros, 1985). Es necesario tener en cuenta el ancho de la aberturas de la tela de gallinero utilizada en la fabricación de las trampas: una pequeña variación en su tamaño podría permitirle a las hembras, particularmente las de la subespecie más pequeña (M. a. obscurus), escapar.[16]
El alimento debe ser ubicado directamente debajo de la entrada de la jaula pero no en montones grandes que puedan resultar extraños al tordo cabecicafé. Las trampas deben contar con objetos sobre los que puedan posarse y agua, preferentemente en puntos desde los cuales la abertura de entrada a la jaula no sea directamente visible. El suelo debe estar libre de césped y hierbas en todo momento. Algunas trampas con el suelo raído en pastizales y terrenos agrícolas a menudo atraen y capturan tordos cabecicafé en ausencia de señuelos o incluso no habiendo un cebo adentro. Una variedad de granos y otras semillas —incluyendo trigo, mijo, maíz molido y girasol— pueden funcionar como cebo.[16]
Los señuelos deben ser una combinación de machos y hembras. La inclusión de al menos dos hembras señuelo entre los machos aumenta sustancialmente la captura de otras hembras. Las proporciones desbalanceadas en favor de las hembras entre las aves señuelo fueron las más eficientes para atrapar ejemplares de ese sexo. La captura de hembras optimizada por medio de las hembras señuelo compensa con creces los escapes ocasionales de hembras atrapadas que puedan parasitar nidos de especies sensibles. Al cortar las alas de las hembras señuelo, pueden minimizarse los escapes. Sin embargo, las aves con las alas cortadas no deben parecer heridas, puesto que esto podría afectar la captura de otros ejemplares.[16]
Otra consideración a tener en cuenta es el lapso de tiempo que las aves señuelo permanecen en la jaula. Las que son mantenidas durante más de dos semanas pueden alterar su comportamiento de tal manera que afectarían negativamente la captura de otros tordos cabecicafé. Esto sucede cuando los ejemplares en la trampa se muestran ansiosos por unirse a otros que se acerquen. Por esta razón, los señuelos deben ser marcados, removidos periódicamente y reemplazados con aves recientemente atrapadas.[16]
El campo de acción de las trampas individuales en las áreas de reproducción no supera con frecuencia los 0,8 km a la redonda (Grzybowski, información no publicada). En Fort Hood (Texas), durante 1991, se colocaron 52 trampas para proteger una población de víreo gorra negra (Vireo atricapilla) distribuida en 152 territorios esparcidos (Hayden y Tazik, información no publicada). En las montañas Wichita (Oklahoma), nueve trampas fueron usadas para proteger aproximadamente 75 territorios del víreo (Grzybowski, información no publicada). A no ser que la población amenazada sea pequeña —y, por lo tanto, ya en serios problemas—, el uso de trampas debería ser extendido y en consecuencia costoso.[16]
La ubicación de las jaulas puede jugar un rol de importancia en la captura de tordos cabecicafé. Las trampas deben ser colocadas en espacios parcialmente abiertos, cerca de potenciales puntos de observación altos, pero no directamente debajo de ellos. Collins y otros (1989) indicaron que las trampas ubicadas en hábitats ribereños densos eran menos efectivas que las dejadas en áreas abiertas adyacentes a dichos hábitats. Como regla general, las jaulas deben colocarse de manera tal que un tordo cabecicafé descansando en el fondo de la misma no pueda divisar una rama u otro objeto en el que posarse a través de la abertura de entrada de la trampa.[16]
Los movimientos diarios del tordo cabecicafé podrían constituir una de las consideraciones más relevantes. Una buena estrategia de emplazamiento de las trampas consiste en ubicarlas entre los sitios de alimentación y las áreas que requieren protección del parasitismo. Muchos tordos cabecicafé en terrenos dominados por colinas optan por atravesarlas por medio de lechos secos de arroyos, bajos y pasos de montaña al trasladarse de las áreas matutinas de reproducción a las vespertinas de alimentación. Las jaulas ubicadas en la entrada de estas áreas o en los pasos pueden ser más efectivas en algunos lugares. En las montañas Wichita, por ejemplo, las trampas dejadas en medio de las áreas de cría del víreo gorra negra redujeron el parasitismo de un 70% a un 30%, duplicando o triplicando su éxito reproductivo. Sin embargo, cuando las trampas eran puestas en el perímetro de las áreas de nidificación del víreo, el parasitismo se reducía a menos del 20% y la fecundidad aumentaba entre seis y ocho veces (Grzybowski, 1990 a).[16]
Otra estrategia consiste en colocar las jaulas en las proximidades de las áreas de alimentación, especialmente en donde se concentran las reses. La tasa de captura de hembras al día por trampa al comienzo de su implementación era arrolladoramente superior cerca del ganado o de bisontes americanos (Bison bison) que lejos de esos animales (Grzybowski, 1990 a). Sin embargo, si el ganado se encuentra disperso, la efectividad de este método se ve comprometida (Rothstein y otros, 1987; Tazik y Cornelius, información no publicada).[16]
Una variable para este último enfoque incluye la rotación del ganado. En la Kerr Wildlife Management Area (Texas), las reses eran ubicadas en pasturas inmediatamente adyacentes a las áreas de cría del víreo gorra negra a comienzos de la temporada de nidificación. La tasa de captura de hembras de tordo cabecicafé aumentó dramáticamente en las trampas más cercanas al ganado, el nivel de parasitismo fue el más bajo registrado y el éxito reproductivo, el más alto documentado (Grzybowski, 1990 b).[16]
A menudo, la tasa de captura es elevada al principio de estos programas de control poblacional y desciende sustancialmente tras un período de captura inicial de entre dos y cuatro semanas. La mayor parte de los tordos cabecicafé son removidos en ese lapso inicial, aunque las jaulas dispuestas en las proximidades de los sitios de alimentación continúan atrapando tordos cabecicafé durante la mayor parte de la temporada.[16]
Los disparos han sido implementados junto a las trampas en Fort Hood (Hayden y Tazik, información no publicada), pero los efectos específicos de los mismos no estaban aislados de los de la captura con jaulas. Alrededor de 247 hembras fueron aniquiladas de esta manera, algunas de las cuales probablemente habrían sido atrapadas de no haber recibido un disparo. No obstante, esta técnica puede ser utilizada para deshacerse de un número significativo de tordos cabecicafé y probablemente resulte útil y más efectiva en algunas áreas con grupos pequeños o esparcidos de ejemplares de especies amenazadas. Sin embargo, los tordos cabecicafé son sensibles a la actividad cerca de las trampas, incluyendo una prolongada presencia humana. Por esa razón, el empleo de armas como método de control poblacional no debería ser efectuado en los sitios en los que se han ubicado trampas.[16]
Debido a que los tordos cabecicafé descansan en grandes grupos fuera de la temporada de reproducción, son potencialmente vulnerables a los esfuerzos a gran escala por controlar su número (Johnson y otros, 1980). Aparentemente, los programas previos de erradicación han surtido poco efecto sobre la población nacional de tordos cabecicafé, posiblemente a causa de que las aves que se concentran en los mismos puntos de descanso comunal proceden en realidad de muchas regiones distintas. En consecuencia, la efectividad del control poblacional en esos sitios de descanso es difusa, no protegiendo ninguna población amenazada en particular. Sin embargo, el control poblacional en los puntos de descanso comunal en invierno puede ser la manera más práctica de reducir su número en hábitats fragmentados en los que la captura con trampas a nivel local sea demasiado costosa.[16]
Entre las soluciones alternativas, se destacan diferentes técnicas destinadas a una gestión del hábitat que dificulte el acceso a los nidos de los huéspedes,[16][23] restrinja la disponibilidad de alimento,[23] disminuya la cantidad de hábitats adecuados[16] y consecuentemente reduzca las poblaciones de tordos cabecicafé y las repercusiones de su peculiar estrategia reproductiva sobre las especies vulnerables.[16][23] La añadidura de huevos artificiales o infértiles también ha demostrado ser efectiva para disuadir el parasitismo.[35]
Robinson y otros (1995) sugieren, como estrategia regional a fin proteger las poblaciones de paseriformes migratorios en el Medio Oeste, preservar y restaurar los vastos segmentos de bosques que constituyan más probablemente fuentes de individuos que ayuden a estabilizar sus números en áreas seriamente afectadas por el parasitismo; asimismo, aconsejan minimizar sus hábitats de alimentación dentro de grandes extensiones ininterrumpidas.[70] Laymon (1987) recomendó evitar el pastoreo cerca de las áreas ribereñas, la eliminación de los feedlots, establos y tambos de las zonas críticas y la reforestación.[23]
Las poblaciones de tordos cabecicafé y las de muchos depredadores de nidos son mayores en áreas fragmentadas en donde se combinan hábitats de alimentación (agrícolas y suburbanos) y de reproducción (bosques y pastizales).[70] En áreas fragmentadas por los terrenos agrícolas, los niveles de depredación en los nidos y parasitismo de puesta son más tan elevados que el éxito reproductivo de muchas poblaciones locales de paseriformes del bosque resulta insuficiente para contrarrestar la mortalidad en individuos adultos.[70] A medida que los hábitats se ven crecientemente fragmentados, esta disfunción reproductiva puede causar decrecimientos regionales en las poblaciones de especies migratorias.[70] Robinson y otros (1993) sugirieron que una gestión del hábitat que reduzca tanto las poblaciones de tordos cabecicafé como las de los depredadores de nidos podría constituir la mejor solución a largo plazo para preservar las poblaciones de las especies migratorias neotropicales; la gestión del hábitat resulta efectiva a una escala mucho mayor que la captura con trampas.[16]
En teoría, las aves que anidan en los angostos corredores ribereños son más susceptibles al parasitismo de puesta que aquellas que nidifican en hábitats más amplios.[23] Esto se debe a que la vegetación de los mismos suele ser lineal, dejando poca superficie inaccesible para los tordos cabecicafé, contrario a lo que sucede con espesuras en forma de círculo o cuadrado.[4][71] Por esta razón, es posible que la tasa de parasitismo pueda reducirse al aumentar la anchura de dichos corredores a través de la reforestación.[23]
Laymon (1987) sugiere que la reforestación es el método más promisorio a largo plazo para controlar el parasitismo de puesta del tordo cabecicafé. Constituye una solución permanente al problema y no requiere mano de obra o financiamiento continuos. Asimismo, los programas de tales características benefician a todas las especies de aves en las comunidades ribereñas, no sólo a la que se pretenda proteger de manera particular del parasitismo de puesta.[23]
Debido a que los tordos cabecicafé se encuentran frecuentemente en terrenos agrícolas, asentamientos humanos y márgenes de hábitats, la mejor estrategia de gestión es preservar amplias áreas ininterrumpidas de un mismo hábitat. Desafortunadamente, las variaciones en el edge effect (“efecto de borde”) entre distintos lugares y la tendencia del tordo cabecicafé a trasladarse largas distancias en su búsqueda de nidos dificultan la tarea de determinar la superficie mínima de hábitat continuo necesaria para limitar el impacto de su parasitismo. Como regla general, sin embargo, los segmentos grandes son preferibles a los reducidos, las franjas ribereñas anchas son mejores que las estrechas y las formas compactas son menos propicias para el parasitismo que las complejas con mucho margen en comparación al área cubierta.[16]
También deben tenerse en cuenta las características de los alrededores del área gestionada. Los que ofrecen escasas oportunidades de alimentación bien podrían no tener problemas con el parasitismo incluso a lo largo de márgenes o pequeños claros. En cambio, si contienen abundantes hábitats alimenticios, las poblaciones de tordos cabecicafé pueden saturar los hábitats reproductivos sin importar su proximidad a los márgenes.[16]
Las estimaciones de la superficie mínima de bosque continuo que se requiere para mantener las poblaciones de las especies migratorias neotropicales varían según la región. Robbins y otros (1989) recomendaron la preservación de al menos 3 mil hectáreas contiguas a fin de proteger las poblaciones locales de paseriformes del bosque en los estados del Atlántico medio. La información sobre áreas moderadamente fragmentadas en el Medio Oeste sugiere que una superficie cubierta de entre 20 mil y 50 mil hectáreas podría ser necesaria ya que la abundancia de tordos cabecicafé en esa región es muy alta y las tasas de parasitismo continúan siendo elevadas incluso a dos kilómetros de los sitios de alimentación. El Biological Advisory Team (1990) del Plan de Conservación de Hábitat de Balcones Canyonlands (Texas) determinó la necesidad de establecer tramos de entre 2 mil y 5 mil hectáreas para minimizar los efectos del parasitismo y la depredación en los nidos del chipe mejillas doradas (Dendroica chrysoparia).[16]
Robinson y otros (1993) recomendaron que la compra de tierras se enfocara en la consolidación de la propiedad de los segmentos de hábitat más grandes dentro de una región y en la restauración de bosques para eliminar las áreas alimenticias de los tordos cabecicafé. También respaldan la compra de tierras y la restauración de los corredores ribereños para asegurar la existencia de hábitats lo suficientemente anchos para preservar las poblaciones del víreo de Bell (Vireo bellii) y el mosquerito saucero (Empidonax traillii). La consolidación de la propiedad de grandes segmentos es particularmente proclive a ser efectiva en hábitats moderadamente fragmentados, en donde las superficies cubiertas de mayor tamaño representarían fuentes potenciales de inmigrantes que recolonizarían los fragmentos más pequeños.[16]
Deben evitarse los proyectos de planificación suburbana y agrícola que impliquen el aislamiento de pequeñas porciones de bosque y favorezcan un incremento en el número de tordos cabecicafé. El planeamiento debe realizarse de manera tal que preserve los espacios boscosos con formas compactas en lugar de aquellos largos y angostos.[16]
Dentro de los segmentos más amplios de un hábitat, debe evitarse cualquier práctica que aumente las oportunidades alimentarias del tordo cabecicafé como cortar el césped a los costados de los caminos y en campings, colocar comederos para aves, construir corrales y utilizar el terreno como pasturas para los animales. Si esto no es viable o práctico, los potenciales sitios de alimentación deberían estar tan concentrados como fuera posible y sería aconsejable la implementación de programas de captura con trampas. Incluso si las tasas de parasitismo del tordo cabecicafé son bajas en estos segmentos grandes, la disminución del éxito reproductivo cerca de las áreas de alimentación podría reducir sustancialmente la disponibilidad de ejemplares de las especies migratorias neotropicales que recolonicen otros más pequeños.[16]
En lugares severamente fragmentados en donde la compra de tierras y la restauración del hábitat no son viables y/o prácticas, la captura en puntos estratégicos podría ser la única manera de preservar las poblaciones restantes de especies sensibles. Dicha captura, sin embargo, probablemente resulte costosa debido a la disponibilidad de tantos sitios de alimentación. En estos hábitats, cuando es implementada en las áreas de reproducción, la captura con trampas podría ser más efectiva que en las de alimentación.[16]
En áreas boscosas aprovechadas en la industria maderera, los métodos de tala deben variar dependiendo de las características del hábitat. En extensas superficies arboladas, como la meseta de Ozark en Misuri, Thompson y otros (1992) descubrieron que los tordos cabecicafé preferían márgenes talados, pero en términos generales no eran más abundantes en presencia o ausencia de ellos. En estos lugares, la técnica de tala utilizada probablemente tenga un impacto menor en los niveles de parasitismo de puesta debido a que, de todas maneras, sus poblaciones están limitadas por la disponibilidad de los hábitats de alimentación. De manera similar, en bosques severamente fragmentados con abundantes hábitats de alimentación, los tordos cabecicafé podrían saturar el hábitat reproductivo sin importar el método de tala implementado.[16]
Sin embargo, probablemente éste no sea el caso en bosques moderadamente fragmentados, en donde la apertura de claros en el dosel arbóreo ofrece al tordo cabecicafé nuevas oportunidades de acercarse a los nidos hospedadores. La tala de superficies de entre 0,1 y 1 hectáreas tiene el potencial de incrementar la frecuencia parasítica debido a que aumenta el margen del hábitat. La información recopilada en un bosque fragmentado en el sur de Illinois (Robinson, información no publicada) mostraba tasas más altas de parasitismo en algunas especies, aunque no en todas, en porciones en las que se habían ido talando pequeños grupos de árboles durante los últimos cinco años.[16]
La franja de árboles que en ocasiones se tala a lo largo de los caminos debe ser tan angosta como sea posible y debe cubrirse con nueva vegetación para evitar el surgimiento de un hábitat propicio para la alimentación del tordo cabecicafé.[16]
De acuerdo con Robinson y otros (1993), deben preservarse y restaurarse amplias superficies contiguas de praderas de pasto alto. La compra de tierras tendría que enfocarse en minimizar la fragmentación y los hábitats alimentarios del tordo cabecicafé. Al igual que con los bosques, es importante evitar los proyectos de planificación suburbana y agrícola que impliquen el aislamiento de pequeñas porciones de pradera. De no ser esto posible, el planeamiento debe procurar la preservación de formas compactas. A no ser que constituyan un punto crítico de hábitat reproductivo para las especies vulnerables, es aconsejable que los árboles secos en pie y los corredores dentro de las praderas o adyacentes a ellas sean eliminados.[16]
Un uso menor o nulo de las praderas alpinas para la alimentación del ganado mejora el éxito reproductivo de las especies ribereñas sensibles, tales como el mosquerito saucero (Empidonax traillii).[23][72] La ausencia del ganado permitiría un mayor crecimiento en el césped, el cual alcanzaría una altura superior a la adecuada para los hábitos alimenticios del tordo cabecicafé.[23] A su vez, esto daría lugar a hábitats ribereños más densos en los que los nidos serían más difíciles de encontrar.[23] La reubicación de los feedlots, establos y tambos lejos de los bosques ribereños reduciría los hábitats de alimentación del parásito cercanos a las áreas de nidificación de las especies amenazadas.[23]
Robinson y otros (1993) sugieren que los feedlots sean diseñados de manera tal que el volumen de grano residual disminuya. La rotación del ganado reduce la superficie cubierta por césped corto, lo cual a su vez podría tener un efecto importante en el tamaño de las poblaciones locales de tordos cabecicafé. Debido a que una mayor disponibilidad de grano residual en invierno podría estar aumentando la tasa de supervivencia del parásito (Brittingham y Temple, 1983), métodos de cosecha más eficientes podrían reducir la cantidad de ejemplares. Sin embargo, una disponibilidad menor de esta fuente de alimento, también podría repercutir sobre las poblaciones de gansos y otras presas de caza, lo cual podría originar un conflicto.[16]
Otra técnica destinada a reducir el parasitismo del tordo cabecicafé implica colocar huevos artificiales o infértiles dentro de los nidos (Ortega y otros, 1994). La añadidura de estos huevos en nidos de tordo sargento (Agelaius phoeniceus) disuadió el parasitismo en esos nidos. Por otro lado, la remoción de huevos depositados de manera natural puede ser inefectiva debido a que otras hembras creerían que los nidos no han sido parasitados y pondrían sus huevos en ellos.[35]
El tordo cabecicafé (Molothrus ater), también conocido como tordo cabecipardo, tordo negro, tordo negro común, tordo cabeza marrón, tordo cabeza café, tordo cuco, vaquero cabecicafé, vaquero de cabeza castaña o boyero negro, es una especie de ave paseriforme de la familia Icteridae propia de América del Norte. Es un pájaro de hábitos parcialmente migratorios que habita en las regiones norteamericanas de clima templado y subtropical. Es sedentario en las regiones australes de su área de distribución, mientras que las aves del norte, en cambio, migran al sur de los Estados Unidos y a México en invierno y regresan a su hábitat de verano en marzo o abril. Se trata de una especie abundante y ampliamente distribuida, de comportamiento gregario, que se alimenta fundamentalmente de semillas y artrópodos.
Exhibe un marcado dimorfismo sexual, y es conocido por ser el parásito de puesta más común de América del norte, depositando sus huevos en nidos de más de 220 especies de aves, reduciendo el éxito reproductivo y amenazando la supervivencia de algunas de ellas. A pesar de compartir esta particular estrategia reproductiva con muchas especies de cucos, no está emparentado con ellos, sino que se trata de un caso de convergencia evolutiva.
Antes del asentamiento europeo, el tordo cabecicafé seguía las manadas de bisontes (Bison bison) a través de las Grandes Llanuras, y quizá también al antílope americano (Antilocapra americana) y al uapití (Cervus canadensis). El parasitismo de puesta complementaba este estilo de vida nómade. Su número creció con la creación de nuevos hábitats abiertos por parte de los colonizadores. Invadió los estados a orillas de los Grandes Lagos y el noreste de Estados Unidos durante el siglo XIX. También se diseminó hacia el oeste, llegando a California. En la actualidad, es posible verlos alimentándose en comederos para aves en áreas suburbanas.
Molothrus ater Molothrus generoko animalia da. Hegaztien barruko Icteridae familian sailkatua dago.
Lehmäturpiaali, aikaisemmalta nimeltään lehmälintu[2] (Molothrus ater) on pohjoisamerikkalainen pesäloinen, joka munii enimmäkseen pienten varpuslintujen pesiin.
Lehmäturpiaali eli aiemmin biisonien seuralaisena, kun biisonit vielä olivat sen elinalueen yleisimpiä isoja nisäkkäitä. Kun lehmät myöhemmin korvasivat biisonit, on lintukin siirtynyt nautakarjan pariin.[2]
Linnun pituus on 15–20 senttiä ja paino 40–50 grammaa. Koiras on kiiltävän musta ja sen pää, niska ja kaula ovat ruskeat. Naaras on joko harmahtava tai ruskea. Harmaa nokka on siemensyöjälinnun korkea tukeva kekonokka.
Lehmäturpiaali elää Pohjois-Amerikassa Kaakkois-Alaskasta Kanadan eteläosien kautta lähes kaikkialle Yhdysvaltoihin ja Meksikon keskiosiin saakka. Sen elinympäristön laajuus on 11 miljoonaa neliökilometriä ja maailman populaation koko noin 56 miljoonaa yksilöä. Alueen pohjoisimmissa osissa se on muuttolintu, joka talvehtii Yhdysvalloissa ja Meksikossa.
Lehmäturpiaalin lisääntynyt kanta uhkaa joidenkin harvinaistuneiden varpuslintujen kantoja ja paikoin on jouduttu vähentämään turpiaalien määrää.
Lehmäturpiaalin elinympäristöä ovat metsänreunat, pensaikot, laitumet, puutarhat, pellot ja niityt sekä preeriat. Metsien harventaminen ja avohakkuut ovat suuresti lisänneet lajille sopivia habitaatteja, sillä se ei viihdy sulkeutuneissa metsissä.
Lehmäturpiaali on loinen, joka munii toisten lintujen pesiin. Se on erikoistunut maljamaisia tai kuppimaisia pesiä rakentaviin lajeihin, ja loisittuja lintulajeja on ainakin 144. Pienin isäntälaji on ollut 10 grammaa painava kiipijä ja suurin 150 gramman painoinen kiurulaji. Naaras lentelee ja etsii munintavaiheessa olevia pesiä ja munii lisääntymiskauden aikana lähes 40 munaa, tavallisesti vain yhden munan kuhunkin pesään. Lehmäturpiaalin munasta kuoriutuu poikanen jo 11 päivän haudonnan jälkeen, eli sen haudontaan kuluu tavallisesti pari-kolme päivää vähemmän aikaa kuin loisittavan linnun omien munien haudontaan. Turpiaalin poikanen kasvaa loisena pesän omien poikasten kanssa, eikä vieritä munia tai poikasia pesän laidan yli, kuten käki tekee. Se on kuitenkin aktiivisempi kerjäämään ja saa enemmän ruokaa kuin pesän omat poikaset. Ainakin täplärastaan poikastuotto on runsaan loisinnan vuoksi pienentynyt ja lajin kanta on taantunut viime aikoina.
Tutkimuksissa on havaittu lehmäturpiaalinaaraan tarkkailevan pesiä, joihin se on muninut. Jos se huomaa munansa poistetuksi, se saattaa rikkoa pesän munat, jolloin loisittavat linnut rakentavat uuden pesän ja munivat uusintapesyeen, johon turpiaali munii munansa 85 %:ssa tapauksia.
Lehmäturpiaali on saanut suomenkielisen nimensä tavastaan seurata karja- ja hevoslaumoja ja niiden jaloista pakenevia hyönteisiä ja muita selkärangattomia, jotka ovat sen ravintoa siementen ohella.
Lehmäturpiaali, aikaisemmalta nimeltään lehmälintu (Molothrus ater) on pohjoisamerikkalainen pesäloinen, joka munii enimmäkseen pienten varpuslintujen pesiin.
Lehmäturpiaali eli aiemmin biisonien seuralaisena, kun biisonit vielä olivat sen elinalueen yleisimpiä isoja nisäkkäitä. Kun lehmät myöhemmin korvasivat biisonit, on lintukin siirtynyt nautakarjan pariin.
Molothrus ater
Le Vacher à tête brune (Molothrus ater) est une espèce d'oiseau de la famille des Icteridae. Le mâle est noir, à tête brune, et la femelle d'un gris-brun plus terne. Cette espèce pratique le parasitisme de couvée, c'est-à-dire que la femelle pond ses œufs dans les nids d'autres espèces d'oiseaux et s'affranchit donc ainsi de l'incubation et de l'élevage des poussins[1]. Cet oiseau grégaire d'Amérique du Nord, à l'origine inféodé aux grands troupeaux de bisons du Midwest, a connu un fort accroissement de population aux XIXe et XXe siècles. Il fait, au début du XXIe siècle, l'objet d'une campagne d'éradication controversée dans certaines zones des États-Unis, ayant pour but de préserver certaines espèces d'oiseaux en danger qui sont victimes de son parasitisme.
Cette espèce présente un dimorphisme sexuel : le mâle adulte présente un plumage noir iridescent sur tout le corps à l'exception de la tête qui est brune ; la femelle adulte est d'un gris-brun léger, un peu plus clair sur la tête et le dessous du corps. Les juvéniles ressemblent à la femelle, mais leurs parties inférieures sont finement rayées et leur dos présente un aspect écailleux dû à de fines marges grises sur le bord des plumes.
Cet oiseau a un bec court mais fort, presque conique. Ces vachers ressemblent aux orioles par leur forme générale, mais leur tête est semblable à celle des pinsons. Ils ont les yeux brun sombre, le bec et les pattes gris foncé.
Les femelles sont en moyenne plus petites que les mâles.
Les adultes mesurent de 15 à 20 cm de longueur[2],[3] et ont une envergure qui varie de 32 à 38 cm. Ils pèsent une quarantaine de grammes (de 38 à 50 g)[4].
Le tarse mesure entre 23 et 25 mm, le culmen de 15 à 17 mm et la longueur de l'aile pliée varie entre 95 et 106 mm[5].
Le Vacher à tête brune peut parfois être confondu avec d'autres espèces.
La femelle peut être confondue avec celle du Carouge à épaulettes, mais cette dernière a beaucoup plus de marques sombres sur la poitrine et présente une calotte gris sombre et une bande claire au-dessus de l'œil.
De loin et en fonction de l'éclairage, la tête du mâle peut paraître sombre et il est alors difficile de le distinguer d'autres oiseaux noirs au plumage luisant vivant dans les mêmes régions. Ainsi, il est parfois confondu avec certains quiscales comme le Quiscale bronzé ou le Quiscale de Brewer, mais ces derniers sont plus gros, ont la queue plus longue, ont de nets reflets bleus dans leur plumage et ont les yeux jaunes et non noirs. Le Vacher à tête brune peut aussi être confondu avec d'autres vachers, comme le Vacher bronzé ou le Vacher luisant qui, bien que de conformation similaire, ont le bec plus long et sont entièrement noirs, sans trace de brun sur la tête ; le Vacher bronzé a en outre les yeux rouges et des reflets bleu-violacé sur les ailes[6].
Le Vacher à tête brune se nourrit au sol, où il préfère marcher plutôt que sautiller. Les graines représentent les trois quarts de son alimentation. Il s'agit généralement de graines d'herbes de prairie, mais il lui arrive de consommer du grain cultivé. Un quart de son alimentation est constitué d'insectes, tels que les sauterelles et divers coléoptères. Les Vachers à tête brune sont beaucoup plus insectivores durant la saison de reproduction, surtout les femelles. Les troupeaux d'herbivores dérangeant un grand nombre d'insectes et les forçant à se déplacer, le Vacher à tête brune qui suit ces troupeaux en profite pour se nourrir facilement, sans se donner la peine de chercher activement ses proies.
Les femelles Vachers à tête brune pondent un grand nombre d'œufs et ont besoin d'un apport de calcium conséquent. Afin de satisfaire ce besoin, elles consomment des coquilles d'escargots, et parfois même l'œuf extrait du nid qu'elles ont parasité[4].
Les Vachers à tête brune sont grégaires et se réunissent souvent en troupes nombreuses, parfois mêlés à d'autres espèces d'oiseaux. Leurs vocalisations varient avec le sexe : les mâles émettent des notes gargouillantes et des sifflements suraigus, un peu glapissants ; les femelles produisent des cris d'appel cliquetants ou des tsip doux[2].
Le grégarisme du Vacher à tête brune n'est pas qu'intraspécifique : il se mêle volontiers à d'autres oiseaux de la famille des Icteridae[2], comme les quiscales, ou des Sturnidae (notamment les étourneaux[6]). Ainsi, il n'est pas rare de voir cet oiseau au sein de nuées comptant une centaine de milliers d'individus[7]. Une nuée d'oiseaux formée dans le Kentucky, réunissant plusieurs espèces comprenant le Vacher à tête brune, a été estimée à plus de cinq millions d'individus[4]. La nuit, les vachers à tête brune se réunissent en dortoirs communs[7].
Le Vacher à tête brune suit aussi assez souvent des mammifères herbivores (des bovidés ou des chevaux) dans leurs déplacements[4],[7].
Cette espèce est un parasite des nichées : la femelle pond ses œufs dans les nids d’autres passereaux. Elle choisit le nid d’espèces essentiellement granivores mais consommant aussi des insectes (les petits vachers ne pourraient pas se développer en n'étant nourris que de graines)[7], particulièrement celles qui construisent des nids en forme de coupe[4]. Après avoir éliminé un des œufs du nid, la femelle pond puis s’en va. L’oisillon Vacher à tête brune est nourri par les parents hôtes au détriment de leur progéniture et devient plus gros : ses frères de nichée finissent très souvent par mourir de faim ou par être éjectés hors du nid par leur encombrant frère adoptif[2].
Plus de 220 espèces différentes d’oiseaux ont leur nid parasité par le Vacher à tête brune[8], et plus de 140 ont été observées élevant des jeunes Vachers à tête brune[9], des petits roitelets jusqu'aux représentants massifs du genre Sturnella[4]. Parmi les hôtes les plus communs, on peut citer la Paruline jaune, le Bruant chanteur, le Bruant familier, le Moucherolle phébi, le Viréo aux yeux rouges, le Tohi à flancs roux, le Tohi tacheté et le Carouge à épaulettes[4],[7]. Ce parasitisme de couvée peut être problématique quand il vise des espèces dont les populations sont déjà en faible effectif, comme la Paruline de Kirtland, le Viréo à tête noire[4] ou le Viréo de Bell[3].
Les parents hôtes remarquent quelquefois l’œuf de vacher et peuvent réagir de différentes façons selon l’espèce. Par exemple, le Gobemoucheron gris-bleu peut déserter le nid parasité, surtout lorsque la femelle Vacher à tête brune dépose ses œufs avant que le gobemoucheron ait fini de pondre les siens[10]. D’autres espèces recouvrent le fond de leur nid d’une nouvelle couche de végétation, comme la Paruline jaune[11]. Les oisillons Vacher à tête brune sont quelquefois éjectés du nid, par exemple par le Moqueur roux[12] ou par le Moqueur polyglotte[13].
Il semble que les Vachers à tête brune vérifient périodiquement l’état de leurs œufs et oisillons après la ponte. Le retrait de l’œuf parasite peut alors entraîner un comportement punitif. Selon une étude du Muséum d'Histoire Naturelle de Floride publiée en 2007, les vachers sont revenus détruire les nids des espèces hôtes dans 56 % des cas où leurs œufs avaient été enlevés. Ce comportement forçait en quelque sorte l’espèce hôte à construire un nouveau nid. Les vachers pondaient ensuite leurs œufs dans les nouveaux nids dans 85 % des cas[14].
Certains grands rapaces tels que le Hibou des marais et le Grand-duc d'Amérique sont susceptibles de s'attaquer aussi bien aux vachers adultes qu'à leurs petits. Ces derniers sont aussi la proie de la couleuvre agile (Coluber constrictor), du serpent-ratier noir (Pantherophis obsoletus) et du Geai bleu[15].
Au printemps, les adultes reproducteurs se réunissent dans une zone boisée pour commencer les parades nuptiales. Dans certaines populations (notamment celles du Kansas), les liens de couple n'existent pas, les femelles s'accouplent avec des partenaires différents et vice-versa ; alors que dans d'autres (notamment en Californie), la monogamie est de mise[2],[7].
La parade nuptiale, réalisée souvent de façon collective par les mâles, comprend des chants et des postures. Ils haussent les épaules, ébouriffent les plumes de la poitrine et du haut du dos, puis saluent profondément, en étalant plus ou moins brièvement la queue en éventail, et achèvent souvent leur démonstration en frottant leur bec sur une branche[16].
La ponte a lieu de début mai à fin juin[5]. Après l'accouplement, les femelles se mettent à la recherche de nids à parasiter. Pour les localiser, elles errent à la lisière des zones boisées ou dans les buissons, cherchant à repérer des oiseaux ayant des comportements de construction, ou à chasser des oiseaux hors du nid. Elles préfèrent pondre dans des nids en forme de coupe, mais peuvent aussi pondre dans des nids au sol, ou suspendus, voire dans des nids situés dans la cavité d'un tronc[4]. Quand le nid à parasiter est choisi, elles suppriment un œuf de la couvée de leur hôte et pondent à la place[2].
Les femelles Vacher à tête brune peuvent pondre jusqu'à 36 œufs pendant une saison de reproduction. Ces œufs mesurent 1,8–2,5 cm × 1,5–1,8 cm et sont blancs ou blanc-gris, fortement tachés de marron ou de gris foncé[4]. L'incubation dure 11 jours en moyenne (de 10 à 12 jours). Les petits pèsent à la naissance à peine plus de deux grammes[17]. Ils sont nus et ont les yeux fermés. Ils grandissent plus vite que leurs frères et sœurs adoptifs, ce qui leur permet d'attirer davantage l'attention et les soins de leurs parents d'adoption. Ils prennent leur essor au bout de 8 à 13 jours[4], mais les juvéniles restent dépendants de leurs parents adoptifs jusqu'à l'âge de 25 à 39 jours[8]. Il n'y a qu'une seule période de ponte par an[17].
Le record de longévité chez cette espèce est de 16 ans et 9 mois pour un individu en liberté[18]. La maturité sexuelle est atteinte à un an, mais les mâles s'accouplent rarement avant l'âge de deux ans[17],[15].
L'aire de répartition du Vacher à tête brune s'étend du sud du Canada jusqu'au plateau mexicain. Les populations sont sédentaires au sud de cette aire de répartition ; les populations plus au nord migrent dans le Sud des États-Unis et au Mexique en hiver, pour retourner sur leur aire de reproduction en mars et avril.
On peut rencontrer cet oiseau dans des milieux ouverts ou semi-ouverts, champs, prairies, arbres de la zone riparienne ou lisière des forêts, où il se déplace souvent en groupe. Il a tendance à éviter les forêts de grande superficie, particulièrement celles de conifères[7].
Les vachers suivent souvent les animaux brouteurs comme les chevaux et les bovidés, dont les mouvements déplacent les insectes.
Avant l’arrivée des Européens, le Vacher à tête brune suivait les hordes de bisons à travers les prairies. Le parasitage des nichées complémentait ce style de vie nomade. Le nombre de vachers a augmenté avec le défrichage des milieux forestiers et l’introduction de nouvelles espèces de brouteurs en Amérique du Nord[7], notamment au XIXe et XXe siècles[15]. Le Vacher à tête brune est maintenant commun dans les banlieues des villes, notamment près des mangeoires à oiseaux.
Cette espèce fut décrite pour la première fois par Pieter Boddaert en 1783 sous le nom Oriolus ater. Il reçoit par la suite plusieurs autres noms scientifiques : Icterus pecoris par Charles-Lucien Bonaparte en 1824, Molothrus pecoris par William Swainson en 1831, et Fringilla ambigua par Thomas Nuttall en 1832. C'est en 1870 que l'espèce reçoit son nom scientifique actuel, seul considéré comme valide, Molothrus ater, attribué par George Robert Gray[19].
Molothrus ater compte trois sous-espèces[20],[7] :
L'UICN a classé cette espèce en catégorie LC (préoccupation mineure), du fait de sa large répartition (estimée à 11 millions de km²) et de sa population importante (estimée à 56 millions d'individus)[21]. Il est par contre protégé, comme tous les oiseaux migrateurs américains, par le Migratory Bird Treaty Act[22]
Comme la plupart des espèces d'oiseaux, il est sensible à la régression ou artificialisation de son habitat et probablement à l'intensification de l'agriculture. Il a subi la régression des troupeaux de bisons et plus récemment des actions visant à réduire ses populations (voir paragraphe précédent).
Molothrus ater
Le Vacher à tête brune (Molothrus ater) est une espèce d'oiseau de la famille des Icteridae. Le mâle est noir, à tête brune, et la femelle d'un gris-brun plus terne. Cette espèce pratique le parasitisme de couvée, c'est-à-dire que la femelle pond ses œufs dans les nids d'autres espèces d'oiseaux et s'affranchit donc ainsi de l'incubation et de l'élevage des poussins. Cet oiseau grégaire d'Amérique du Nord, à l'origine inféodé aux grands troupeaux de bisons du Midwest, a connu un fort accroissement de population aux XIXe et XXe siècles. Il fait, au début du XXIe siècle, l'objet d'une campagne d'éradication controversée dans certaines zones des États-Unis, ayant pour but de préserver certaines espèces d'oiseaux en danger qui sont victimes de son parasitisme.
Il vaccaro testabruna, o mòlotro (Molothrus ater [Boddaert, 1783]) è un piccolo uccello passeriforme della famiglia Icteridae[2].
Gli esemplari adulti hanno un becco simile a quello del fringuello e occhi scuri. Il maschio adulto è principalmente nero iridescente con la testa marrone. La femmina adulta è grigia con una gola più pallida e una fine striatura nell'addome.
Viaggiano spesso in stormi, a volte mescolandosi a Agelaius phoeniceus o a storni.
Questi uccelli si nutrono a terra, spesso seguendo animali da pascolo come cavalli e mucche per catturare gli insetti che si muovono sopra questi grossi animali. Mangiano principalmente semi e insetti.
Tempo fa, il vaccaro testabruna seguiva le mandrie di bisonti americani attraverso le praterie. Il loro comportamento di nidificazione parassita complementava questo stile di vita nomade. Il loro numero aumentò con la diminuzione delle aree forestali e l'introduzione di nuovi uccelli dai coloni attraverso il nord America. Il vaccaro testabruna si vede ora comunemente nelle mangiatoie suburbane.
Questo uccello è un parassita dei nidi, similmente al cuculo: depone le sue uova nei nidi di altri piccoli passeriformi, particolarmente quelli che costruiscono nidi a forma di coppa, come l'usignolo giallo. Il giovane vaccaro testabruna viene nutrito dai genitori ospiti alle spese del loro piccolo.
Le femmine di vaccaro testabruna possono deporre fino a 36 uova in una stagione. Sono conosciute oltre 140 specie sfruttate dal vaccaro per crescere la propria prole. I genitori ospiti a volte notano l'uovo di vaccaro, ma le diverse specie reagiscono in modi differenti. La Dumetella carolinensis distrugge l'uovo beccandolo, altre specie semplicemente costruiscono un nuovo strato sopra al fondo del nido originario; le nidiate di Molotro vengono a volte espulse da questo. Questo rifiuto, tuttavia, può originare dei comportamenti "mafiosi", secondo uno studio del Florida Museum of Natural History.[3] Quando l'uovo parassita è stato rimosso dal nido ospite, il vaccaro ritorna per saccheggiarlo nel 56% dei casi. Inoltre, il vaccaro ha anche distrutto nidi per costringere gli ospiti a costruirne di nuovi, in modo da poterli sfruttare. I vaccari hanno poi deposto le proprie uova nei nuovi nidi nell'85% dei casi.
L'areale di Molothrus ater si estende dal Canada e dagli Stati Uniti d'America sino al Messico, e ad alcune isole caraibiche quali Bahamas, Cuba, Saint-Pierre e Miquelon e Turks e Caicos.[1]
Nell parte meridionale dell'areale ha abitudini stanziali, mentre le popolazioni settentrionali migrano verso sud per svernare, ritornando ai siti di nidificazione in marzo- aprile.
Il vaccaro testabruna, o mòlotro (Molothrus ater [Boddaert, 1783]) è un piccolo uccello passeriforme della famiglia Icteridae.
Rudagalvis karviaganis (lot. Molothrus ater, angl. Brown-headed Cowbird, vok. Braunkopf-Kuhstärling) – trupialinių (Icteridae) šeimos paukštis.
Kūnas 19 cm ilgio. Patinas išsiskiria rudu gobtuvu.
Paplitęs JAV pietinėje dalyje ir pakrantėje, o vasarą atskrenda iki šalies centre esančių valstijų ir Kanados.
Rudagalvis karviaganis (lot. Molothrus ater, angl. Brown-headed Cowbird, vok. Braunkopf-Kuhstärling) – trupialinių (Icteridae) šeimos paukštis.
Kūnas 19 cm ilgio. Patinas išsiskiria rudu gobtuvu.
Paplitęs JAV pietinėje dalyje ir pakrantėje, o vasarą atskrenda iki šalies centre esančių valstijų ir Kanados.
Rudagalvio karviaganio giesmė
De bruinkopkoevogel (Molothrus ater) is een zangvogel uit de familie Troepialen (Icteridae).
Het mannetje van deze soort lijkt wel wat op de Europese merel. Hij is echter niet geheel zwart maar heeft een bruine kop. Het vrouwtje of pop is minder opvallend bruin. De lichaamslengte bedraagt 19 cm.
De vogel heeft van de menselijke activiteiten duidelijk groot voordeel gehad. Koevogels (koespreeuwen) zijn broedparasieten. Net als de Europese koekoek bouwen zij zelf geen nest, maar leggen hun eieren in het nest van andere vogels. Oorspronkelijk kwamen zij voor op de prairie en volgden daar de trek van de bizon. Het was daarbij ongetwijfeld een voordeel niet zelf voor de jongen te hoeven zorgen. Door ingrijpen van de mens is die levensstijl grondig veranderd, maar anders dan de bizon heeft de koevogel daar alleen maar van geprofiteerd. Door het kappen van de uitgestrekte bossen ten oosten van de prairie kwam er veel gebied open te liggen waar de vogel zich goed in thuis voelde. Op hun beurt leden een aantal andere vogelsoorten daar weer schade van omdat zij nu ook ongewild gastheer voor de jongen van de koevogel werden. Er is zelfs een vogelsoort, Kirtlands zanger (Setophaga kirtlandii) die daardoor op het randje van uitsterven gekomen is.
Deze soort komt voor in de kustgebieden en in het zuiden van de VS. Hij is een zomergast in de centrale staten en in Canada. De vogel is in een groot deel van Noord-Amerika een vertrouwde verschijning in een open landschap, maar ook in stadsparken kan hij aangetroffen worden.
De soort telt drie ondersoorten:
De bruinkopkoevogel (Molothrus ater) is een zangvogel uit de familie Troepialen (Icteridae).
Brunhovudtrupial (Molothrus ater) er ein mellomstor sporvefugl i trupialfamilien som lever i temperert til subtropisk Nord-Amerika frå nordvestlege Canada til sørlege Mexico. Han er ein reirparasitt, avhengig av andre fugleartar som vertsfugl for eiget avkom.
Slektsnamnet Molothrus kjem frå gammalgresk molos, 'kamp'; throsko, 'å impregnere'. Det spesifikke artsnamnet ater er latin for kjedeleg, svart.[1]
Brunhovudtrupialen har kroppsform og farger som andre artar i familien sin, men er prega av eit litt meir finkliknande hovud, og nebbet er dessutan relativt kortare enn hjå dei fleste andre trupialartar. Vaksne hannar har fjørdrakt i iriserande svart med ei brun hette som strekker seg ned på brystet og over nakke mot skuldrene. Vaksne hofuglar er litt mindre og er diffus grå til brun med ein bleika strupe og veldig uklår streking på undersida. Total kroppslengd for hannar er ca. 18-20 centimeter, hoer er ca. 2 cm kortare. Kroppsmassen kan variere i området 32-57 gram, avhengig av kjønn og underart.[2]
Denne arten lever i opne habitat, gjerne jordbruksområde, ved utkant av skog, òg i folkesette område. Dei kan opptre i store flokkar, nokon gonger saman med andre artar. Desse fuglane beitar på bakken, ofte nær beitedyr som hestar og kyr for å fange insekt skremt opp av dei større dyra. Føda er hovudsakleg frø og insekt. Brunhovudtrupialar er standfuglar i dei sørlege delane av utbreiingsområdet; Hekkepopulasjonane lengst nord trekker til sørlegaste USA og Mexico om vinteren, og returnerer til sommarhabitata rundt mars eller april.
Som reirparasittar treng dei tilgang på reir av andre fugleartar, særleg dei som bygger koppliknande reir. Meir enn 140 vertsartar har lykkast i å fostre opp ungar.[3]
Nokre vertsartar, som husrosenfink, matar ungar med eit vegetarisk kosthald. Dette er ueigna for unge brunhovudtrupialar, noko som betyr at nesten ingen overlever hos denne verten til dei er flygedyktige.[4]
Storleiken på populasjonen er ikkje estimert og er trudd å vere minkande. Arten er klassifisert som globalt livskraftig.[5]
Eit individ av arten er registrert på Jomfruland i juni 1987, og ein brunhovudtrupial blei observert på Tynset i mai 2010.[6]
Brunhovudtrupial (Molothrus ater) er ein mellomstor sporvefugl i trupialfamilien som lever i temperert til subtropisk Nord-Amerika frå nordvestlege Canada til sørlege Mexico. Han er ein reirparasitt, avhengig av andre fugleartar som vertsfugl for eiget avkom.
Slektsnamnet Molothrus kjem frå gammalgresk molos, 'kamp'; throsko, 'å impregnere'. Det spesifikke artsnamnet ater er latin for kjedeleg, svart.
Brunhodetrupial (vitenskapelig navn Molothrus ater) er en spurvefugl.
Arten finnes Bahamas, Canada, Cuba, Mexico, Saint-Pierre og Miquelon, Turks- og Caicosøyene og USA.[1]
Brunhodetrupial (vitenskapelig navn Molothrus ater) er en spurvefugl.
Arten finnes Bahamas, Canada, Cuba, Mexico, Saint-Pierre og Miquelon, Turks- og Caicosøyene og USA.
Starzyk brunatnogłowy[3], starzyk rudogłowy (Molothrus ater) – gatunek ptaka z rodziny kacykowatych (Icteridae). Znany pasożyt lęgowy u ponad 100 gatunków ptaków z Ameryki Północnej. Przyczynił się do spadku liczebności wireonków, lasówek, tanagr i niektórych kacyków. Ubarwienie jaj inne niż jaj gospodarzy. Pisklęta wylęgają się wcześniej, rosną szybciej i są większe; wyrzucają z gniazda pisklęta gospodarzy.
Wyróżniono trzy podgatunki M. ater[4][5]:
Długość ciała 15–20 cm. Głowa samca kawowobrązowa; tułów błyszcząco czarny. Samica jednolicie szarobrązowa. Młode ptaki brązowe, jaśniejsze od spodu, często w ciemnobrązowe kreski.
Północno-środkowa, środkowa i południowa część Ameryki Północnej. Zimę spędza w południowej części Ameryki Północnej.
Starzyk brunatnogłowy, starzyk rudogłowy (Molothrus ater) – gatunek ptaka z rodziny kacykowatych (Icteridae). Znany pasożyt lęgowy u ponad 100 gatunków ptaków z Ameryki Północnej. Przyczynił się do spadku liczebności wireonków, lasówek, tanagr i niektórych kacyków. Ubarwienie jaj inne niż jaj gospodarzy. Pisklęta wylęgają się wcześniej, rosną szybciej i są większe; wyrzucają z gniazda pisklęta gospodarzy.
Brunhuvad kostare[2] (Molothrus ater) är en nordamerikansk fågel i familjen trupialer som är en av få tättingar som är boparasiter.[3]
Brunhuvad kostare har en mer finkliknande näbb och är med en kroppslängd på 16-22 centimeter något mindre i storlek än de flesta andra trupialer. Hanen är glänsande svart med ett brunt huvud medan den något mindre honan är grå med blek strupe och fint streckad undersida.[4]
Hane brunhuvad kostare sjunger en bubblande serie med låga gurglande toner följt av tunna glidande visslingar, drygt en sekund lång. Både hona och hane yttrar vidare olika typer av visslande, klickande och tjattrande läten.[4]
Brunhuvad kostare delas in i fyra underarter med följande utbredning:[3]
Underarten californicus inkluderas ofta i obscurus.[5]
Fågeln är en mycket sällsynt gäst i Europa med fynd från framför allt Storbritannien, men också Norge, Frankrike och Tyskland.[6]
Arten trivs i öppet eller halvöppet landskap, i gräsmarker med låga och spridda träd likväl som skogsbryn, buskage, prärier, betesmarker, fruktträdgårdar och i bostadsområden.[4] Den ses ofta i flockar, ibland med rödvingetrupialer (framför allt under våren) eller bobolink (hösten), men även mindre båtstjärtar och starar.[7] Fåglarna födosöker på marken, mestadels efter frön från gräs och ogräs, ibland även säd.[4] Insekter som gräshoppor och skalbaggar utgör ungefär en fjärdedel av dess föda.[4] Den följer ofta betande djur (därav namnet) på jakt efter insekter som dessa skrämmer upp.[4]
Den brunhuvade kostaren är känd för sin boparasitism. Den har konstaterats lägga ägg i så många som 220 olika fågelarters bon, främst tättingar men även kolibrier och rovfåglar,[8][9] medan 140 arter ha dokumenterats föda upp unga kostarar på dera egna ungars bekostnad.[10] Honor av brunhuvad kostare kan lägga upp till så många som 36 ägg under en häckningssäsong. Olikt göken anpassas inte äggens utseende efter det hos värdartens ägg.
Brunhuvad kostare är dock inte alltid så framgångsrik som det kan låta. Exempelvis husfinken matar sina ungar med vegetabilisk föda som inte passar kostareungar, varvid nästan inga överlever.[11] Vissa värdarter känner igen ett kostare ägg, varpå exempelvis svartbrynad myggsnappare överger boet, gul skogssångare gömmer ägget under bomaterial så att det dör.[12] och rödbrun härmtrast stöter ut ägget från boet.[9] Experiment visar att grå kattfågel avvisar fler än 95% av alla kostareägg.[13]
Även värdartens ungar kan anpassa sitt beteende så att de förlorar lika mycket på att det finns en konkurrerande kostareunge i boet. Hos sångsparven ändrar de sina läten både i frekvens och tonhöjd så att de liknar kostareungens, vilket gör att de får lika mycket uppmärksamhet av föräldrarna och därför får mat lika ofta.[14]
Kostaren kan svara på värdparets försvarsmekanismer. Efter äggläggning återvänder de till boet för att kontrollera ägget. Om ägget har avlägsnats hämnas kostaren på ett sätt titulerat "maffiabeteende". Enligt en studie publicerad 1983 vid Florida Museum of Natural History återvänder kostaren för att helt rensa boet på ägg vid 56% av tillfällena eller förstör boet för att tvinga värdparet att bygga ett nytt, varpå kostaren till 85% lägger nya ägg i det nya boet.[15]
Brunhuvade kostaren är en mycket talrik fågel med en världspopulation på 120 miljoner häckande individer.[16] Ursprungligen bebodde den prärier i centrala Nordamerika där den följde flockar med bisonoxar, men både spred sig och ökade kraftigt i antal när européerna anlände med boskap och högg ner skogen.[4] På senare tid har den dock minskat något, mellan 1966 och 2015 med 31%,[17] dock inte tillräckligt kraftigt för att den ska betraktas som hotad. Internationella naturvårdsunionen IUCN kategoriserar den därför som livskraftig (LC).[1] Brunhuvade kostarens boparasitiska beteenden kan utgöra en risk för fåglar med små populationer, som kirtlandskogssångare och svarthuvad vireo.[4]
Brunhuvad kostare (Molothrus ater) är en nordamerikansk fågel i familjen trupialer som är en av få tättingar som är boparasiter.
Вашер буроголовий (Molothrus ater) - це невеликий облігатний гніздовий паразит, представник родини трупіалових, поширених від зони помірного клімату до субтропіків Північної Америки. Вони є постійними мешканцями в південних районах свого ареалу; північні птахи мігрують до південних Сполучених Штатів і Мексики взимку, повертаючись до свого літнього місця проживання близько березня або квітня. [2]
Вашер буроголовий на вигляд є типовим представником трупіалових, дещо відрізняючись головою і дзьобом, меншими, ніж у більшості іктерид. Дорослий самець - переливчасто-чорного кольору з коричневою головою. Доросла самиця трохи менша, тьмяно-сіра зі світлішим горлом і дрібними цятками на нижній частині. Загальна довжина - 16-22 см, середній розмах крил становить 36 см[3]. Маса тіла може варіювати від 30 до 60 г, при середньому для самиць 38,8 г, у той час як середній показник самців 49 г[4]
Цей вид живе на відкритих або напіввідкритих місцях і часто подорожує у зграях, іноді змішаних з червоноплечими еполетниками (особливо навесні) і ґоґлу (Dolichonyx oryzivorus) (особливо восени), а також звичайними ґраклами або європейськими шпаками[5]. Ці птахи живляться на землі, часто йдучи слідом за пасовищними тваринами, — кіньми та коровами, ловлячи комах, приваблених великими тваринами. Вони в основному їдять насіння і комах.
Перед нашестям європейців вашери буроголові століттями ходили за стадами бізонів через прерії. Їхня паразитична гніздова поведінка йшла в парі з цим кочовим способом життя. Їх популяція в історичному періоді розширилася завдяки збільшенню площ пасовищ за рахунок масового вирубування лісів європейськими поселенцями в Північній Америці. Вашер буроголовий тепер є частим відвідувачем міських і приміських годівничок.
Вашер буроголовий є облігатним гніздовим паразитом: він відкладає свої яйця в гніздах інших дрібних горобиних, особливо тих, які будують чашоподібні гнізда. Яйця вашера буроголового були задокументовані в гніздах принаймні 220 видів господарів, включаючи колібрі і хижаків[6][7]. Молодого вашера батьки-господарі годують за рахунок власної молоді. Самиці вашерів можуть відкладати 36 яєць за сезон. Відомо, що понад 140 різних видів птахів виростили молодих вашерів. [8]
На відміну від звичайної зозулі, у вашерів буроголових нема специфічних паразитичних рас, яйця яких імітують тих чи інших господарів.
Деякі види господарів, такі як чечевиця садова, годують своїх пташенят лише рослинною їжею. Це не підходить пташенятам вашера, тож вони практично не виживають у гніздах чечевиць[9].
Вашери буроголові не вигодовують власних пташенят, натомість відкладають яйця в гнізда інших видів птахів. Як наслідок, молоді вашери не отримують специфічних для виду візуальних та слухових зразків, як інші птахи. Незважаючи на це, вашери здатні розвивати характерні для їхнього виду співочі, соціальні та репродуктивні навички[10]. Дослідження 2017 року продемонструвало, що мозок вашера буроголового настроєний на сприйняття вокалізацій інших вашерів, що дозволяє молоді знаходити свої зграї і приєднуватися до них. Ці вокалізації є послідовними для всіх популяцій вашерів та служать своєрідним паролем для розпізнавання видів. Якщо пташеня вашера не отримує цих сигналів вокалізації до певного віку, воно помилково наслідуватиме "прийомних батьків". [11]
Отримання яйця вашера і вирощування його пташеняти може дорого обійтись птахам виду-господаря. Гнізда пісняра горихвісткового (Setophaga ruticilla) з підкинутим вашером, як виявилось, мають статистично вищий шанс нападу хижаків, що може бути пов'язано з голосними вимогливими криками пташеняти вашера, але також частково пояснюється тим, що гнізда, обрані для паразитизму, також мають більшу ймовірність стати жертвою нападу[12].
Птахи-господарі іноді помічають яйце вашера, і різні господарі реагують на яйце по-різному. Деякі, як комароловка сиза (Polioptila caerulea), покидають своє гніздо, втрачаючи власні яйця. Деякі, як пісняр горихвістковий (Setophaga ruticilla), закопують чуже яйце під гніздовий матеріал, де воно гине[13]. А деякі, як тремблер прямодзьобий (Toxostoma rufum), фізично викидають яйце з гнізда[14]. За даними досліджень, пересмішник сірий (Dumetella carolinensis), відомий господар вашерів, викидає яйця вашера в 95% випадків; для цього виду вартість прийняття яєць вашера (і через те можливість втрати власних яєць або пташенят через голод або дії підкинутого пташеняти) є набагато вищою, ніж вартість відмови від цих яєць (враховуючи, що господар може помилково викинути своє власне яйце)[15]. Сірі пересмішники Іноді викидають з гнізда пташенят вашера буроголового. Пташенята видів-господарів також можуть змінювати їх поведінку у відповідь на наявність пташеняти вашера. Пташенята пасовки співочої (Melospiza melodia) у гніздах з паразитом вашером підлаштовують свої вокалізації за частотою і амплітудою, так що вони нагадують заклик пташеняти вашера, і ці пташенята, як правило, отримують їжу однаково часто, як і пташенята в гніздах без паразитів[16].
Схоже, що буроголові вашери періодично перевіряють свої яйця і пташенят після того, як вони їх «здали на виховання». Видалення паразитного яйця може викликати реакцію відповіді, що називається « мафіозною поведінкою». Згідно з дослідженням Музею природної історії Флориди, опублікованим у 1983 році, вашер повертався, щоб розорити гнізда різних видів господарів у 56% випадків, коли його яйця видаляли. Крім того, він також нищив гнізда, проявляючи поведінку т.зв. «фармінгу», щоб змусити господарів будувати нові. Потім вашер підкинув яйця в нові гнізда у 85% випадків[17][18]
Люди іноді беруть участь у програмах контролю за вашером з наміром захистити види, на які негативно впливає гніздовий паразитизм вашерів. Дослідження гнізд віреона короткокрилого (Vireo bellii) виявило обмежену ефективність цих контрольних програм, продемонструвавши, що вилучення вашерів буроголових з ділянки може призвести до парадоксального наслідку підвищення продуктивності вашерів на цьому місці, оскільки при цьому менша кількість паразитованих гнізд була покинута господарями, що створило кращі умови для яєць вашерів, які все ще залишались[19].
Вашер буроголовий (Molothrus ater) - це невеликий облігатний гніздовий паразит, представник родини трупіалових, поширених від зони помірного клімату до субтропіків Північної Америки. Вони є постійними мешканцями в південних районах свого ареалу; північні птахи мігрують до південних Сполучених Штатів і Мексики взимку, повертаючись до свого літнього місця проживання близько березня або квітня.
Molothrus ater là một loài chim trong họ Icteridae.[1]
Molothrus ater (Boddaert, 1783)
Подвиды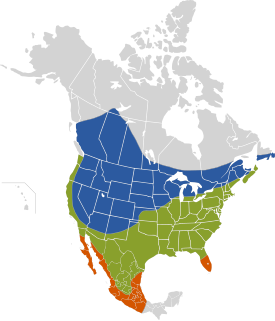
Места гнездования Круглогодично
ЗимовкаБуроголо́вый коро́вий трупиа́л[1], или воловья птица[1] (лат. Molothrus ater) — североамериканская певчая птица семейства трупиаловые.
У птицы короткий, похожий как у зяблика клюв и тёмные глаза. Самец окрашен преимущественно в чёрный с отливом цвет, голова коричневого цвета. Самка окрашена в серый цвет с более светлой грудью.
Буроголовый коровий трупиал обитает на открытой и полуоткрытости на большей территории Северной Америки. В то время как южные популяции — это оседлые птицы, северные мигрируют на юг США или в Мексику. Птица перемещается небольшими стайками, иногда вместе с красноплечим чёрным трупиалом и скворцом. Зимой птица — частый гость кормушек.
Буроголовый коровий трупиал ищет на земле насекомых, которых привлекает или вспугивает пасущийся на лугах скот.
Буроголовый коровий трупиал — это гнездовой паразит, который откладывает свои яйца в гнёзда других маленьких певчих птиц, особенно в чашеобразные гнёзда, такие как у жёлтой древесницы. Птенцы буроголового коровьего трупиала кормятся гостевыми родителями за счёт собственного подрастающего поколения. Буроголовый коровий трупиал может откладывать до 36 яиц в год. Более 140 видов птиц известны как жертвы этого гнездового паразита. Если гостевые родители узнают чужие яйца, они реагируют по-разному. Кошачий пересмешник расклёвывает яйца. Другие птицы строят новое гнездо над старым. Иногда проклюнувшихся птенцов выбрасывают из гнезда.
Исследования Джеффри Хувера и Скотта Робинсона показали, что буроголовый коровий трупиал в половине случаев разрушает гнёзда лимонного певуна, если тот отказывается выкармливать чужой выводок. Если ранее лимонный певун успешно защитил собственное гнездо от откладывания яиц гнездовым паразитом, то тогда оно оставалось нетронутым.
Буроголо́вый коро́вий трупиа́л, или воловья птица (лат. Molothrus ater) — североамериканская певчая птица семейства трупиаловые.
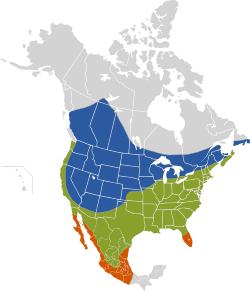
褐頭牛鸝(學名:Molothrus ater,英语:brown-headed cowbird)是牛鸝屬下的一種小型鳥類,分佈于北美洲的溫帶和亞熱帶地區。南方的褐頭牛鸝一般並不遷徙,而北方的褐頭牛鸝則會飛到南方過冬,三月至四月間返回北方。[2]
和該屬的其它生物一樣,褐頭牛鸝有巢寄生的習性。它們會把卵產在其它鳥类的巢穴里等待孵化,還會定期檢查,一旦發現自己的卵遭到遺棄,就可能攻击寄主。
褐頭牛鸝由荷蘭博物學家皮耶特·博塔埃特於1783年命名,當時學名為Oriolus ater。後來夏爾·呂西安·波拿巴在1824年又給出了學名Icterus pecoris,1831年威廉·斯溫森則給出Molothrus pecoris,此外還有1832年托馬斯·納托爾給出的Fringilla ambigua。1870年才出現了現在使用的學名Molothrus ater,提出者是喬治·羅伯特·格雷。[3]
褐頭牛鸝是典型的牛鸝屬鳥類,但其頭部和喙更像燕雀,也比其他的同屬生物較小。成年雄性背部羽毛有閃亮的黑色光澤,頭部則是褐色的,因此而得名。成年雌性則比雄性更小、羽毛也沒那麼鮮艷,通體呈黯淡的灰色,只有喉部是白色的,其腹部有明顯的條紋。褐頭牛鸝體長在16~22厘米(6.3~8.7英寸)之間,翼展平均為36厘米(14英寸)。[5] 體重在30~60克(1.1~2.1盎司)之間,其中雌性平均重38.8克(1.37盎司),雄性則達49克(1.7盎司)。[6]
它們一般出現在開闊或半開闊的鄉村地區,通常集群飛翔。褐頭牛鸝群中有時會混入紅翅黑鸝(常見於春季)和食米鳥(常見於秋季),此外普通擬八哥和紫翅椋鳥也可能會出現在褐頭牛鸝群中。[2] 它們在地表覓食,而又常會跟隨牛群或馬群來捕食牛馬身上的蟲子。褐頭牛鸝也以植物的果實為食。
成年雄性會互相爭鬥或比賽歌唱來奪取配偶,而找到合適的雌性之後,褐頭牛鸝一般並不會再去尋找更多的配偶。[7]
褐頭牛鸝有巢寄生的習性,它們將自己的卵產在其他雀形目鳥類的巢中,而其中又特別偏好杯狀巢。有記載的褐頭牛鸝寄生物種已經達到220種,一些褐頭牛鸝甚至把卵產在蜂鳥和猛禽的巢穴中。[8][9] 它們寄希望於寄生的鳥巢主人會幫它們孵化幼鳥,而已知有超過140種鳥類都會孵化褐頭牛鸝卵。一隻褐頭牛鸝一季可以產下36枚卵。[10]
實際上像旅鶇這樣的一些鳥類並不會理會這些外來者的卵,大約95%的灰嘲鶇會拒絕撫育褐頭牛鸝。[11][12][9] 而朱雀這樣的一些純素食鳥類也因為無法給幼年褐頭牛鸝提供合適的食物,而只能令它們餓死。[13]
而接受褐頭牛鸝的卵對一些鳥類來說還有著致命的威脅。以橙尾鸲莺為例,因為褐頭牛鸝的幼鳥叫聲過大,飼育有褐頭牛鸝的橙尾鸲莺巢有更大的被捕食者發現的危險。但同時也有另一種可能性,也就是說:因為它們的巢如此容易地就被褐頭牛鸝產了卵,其防禦性必定也不高。[14]
至於接受褐頭牛鸝卵的鳥類巢穴中則可能會出現另一種情況,以北美歌雀為例,它們的幼鳥會改變自己的發聲頻率來契合巢中寄生的褐頭牛鸝,而這兩種幼鳥也會得公平的哺育。[15]
褐頭牛鸝並不是產下卵之後就一飛了之,它們會定期返回產下卵的巢穴去檢查狀況。如果發現自己的卵被遺棄,有可能就會對這個鳥巢發起攻擊。依照佛羅里達自然歷史博物館的研究,褐頭牛鸝攻擊棄其卵者巢穴的可能性達56%,它們甚至會直接摧毀寄主巢穴,迫使它們重新建巢,而有85%的褐頭牛鸝在此之後又會將卵產入其中。[16]
|access-date=中的日期值 (帮助) |access-date=中的日期值 (帮助) 褐頭牛鸝(學名:Molothrus ater,英语:brown-headed cowbird)是牛鸝屬下的一種小型鳥類,分佈于北美洲的溫帶和亞熱帶地區。南方的褐頭牛鸝一般並不遷徙,而北方的褐頭牛鸝則會飛到南方過冬,三月至四月間返回北方。
和該屬的其它生物一樣,褐頭牛鸝有巢寄生的習性。它們會把卵產在其它鳥类的巢穴里等待孵化,還會定期檢查,一旦發現自己的卵遭到遺棄,就可能攻击寄主。

コウウチョウ(香雨鳥、学名: Molothrus ater)は、スズメ目ムクドリモドキ科に分類される鳥類の一種。
カナダ南部からアメリカで繁殖する。北方で繁殖した個体は、冬期アメリカ南部からメキシコに渡り越冬する。
他の種類の鳥類の巣に托卵する習性がある。
ウィキメディア・コモンズには、コウウチョウに関するカテゴリがあります。