pt-BR
nomes no trilho de navegação


This is a large fast-growing multipurpose tree (up to 40 metres) from South America; it bears edible fruits with oily seeds and is a well known remedy for its medicinal uses because is effective against malaria, dysentery, endoparasites, some viruses, etc.
El aceituno, o Simarouba amara ye una especie d'árbol perteneciente a la familia Simaroubaceae. Alcuéntrase en Florida nos Estaos Xuníos, sur de Méxicu, Centroamérica, y Antilles Mayores[1]. En Cuba denominar aceitillo[2], en Guatemala y Hondures aceituno o talchocote[2].
Son árboles o parrotales, qu'algamen un tamañu de 3–30 m d'altu; plantes dioiques. Les fueyes imparipinnaes, de 10–30 cm de llargu, con 6–18 foliolos, obovaos, de 3–9 cm de llargu y 1–3 cm d'anchu, arredondiaos a emarginaos nel ápiz, acuminaos a agudos na base, xeneralmente verde foscos o verde olivos nel fexe, mariellu-verdosu y más claros nel viesu. Les panícules de 10–30 cm de llargu, flores unisexuales, sépalos 5, 1 mm de llargu, verdes o verde olivos; pétalos 5, 4–7 mm de llargu, xeneralmente mariellos pero frecuentemente con matices verdes o colloraos; estames 10, filamentos 1–2.5 mm de llargu, con un apéndiz na base, anteres 1–1.5 mm de llargu, bien amenorgaes nes flores pistiladas; xinecéu 5-carpelar y 5-locular, estigmes llibres. Drupas 1–5, estruyíes, elípticu-lenticulares, 1.5–2 cm de llargu y 1–1.5 cm d'anchu, anaranxaes o coloraes al maurecese.
Común en llugares abiertos y montes caducifolios, zones del pacífica y atlántica a una altitú de 0–500 metros; dende Belice a Brasil y nes Antilles. Esisten dos formes d'esta especie: una que correspuende al tipu de S. amara y ye un árbol grande de montes, con pétalos y anteres más pequeños; y l'otra forma, típica d'ambientes abiertos, ye un árbol más pequeñu, con pétalos y anteres llixeramente más grandes y ye representativu del taxón llamáu S. glauca. La dificultá d'asignar tolos especímenes a una d'estos dos especies descrites amás de la esistencia de numberoses formes entemedies, son argumentos pa xunir estos nomes so una sola especie.
Les sos granes producen un aceite comestible. L'árbol ye bien afechu pal clima templáu y les rexones tropicales húmedes. El so cultivu depende de la distribución de les precipitaciones, la capacidá de retención d'agua del suelu y el mugor del sosuelu. Ye afechu pa temperatures de 10 a 40 ° C . Puede crecer a altores dende'l nivel del mar a 1.000 m . Algama un tamañu de 12 a 15 m d'altor y tien un valumbu de 7.6 a 9.1 m. Tien flores de color mariellu y la fruta carnoso forma d'óvalu allargáu de color púrpura.
Puede arrobinase por granes, ensiertos y cultivu de texíos teunolóxicos. Los frutos recoyer nel mes d'abril / mayu, cuando tán madures y ensúguense al sol mientres una selmana. La piel dixébrase y cultívense diches granes en bolses de plásticu pa producir plantines, a los 2 - 3 meses d'edá los árboles nuevos pue ser tresplantáu a un plantíu.
L'árbol forma un bien desenvueltu sistema de raigaños y xamasca siempres verde mestu que controla de manera eficiente la erosión del suelu, ye compatible cola vida microbiana del suelu, y ameyora la posición de les agües soterrañes. Amás de la conversión d'enerxía solar n'enerxía bioquímica mientres tol añu, compruébase'l sobrecalentamientu de la superficie del suelu mientres tol añu y especialmente mientres el branu. El plantíu a gran escala en terrenales baldíos facilita la recuperación de tierres baldías, convierte l'acumuladura atmosférica de dióxidu de carbonu en osíxenu y contribúi al amenorgamientu del efeutu invernaderu o calentamientu global.
Del aceituno:[3] utilícense les fueyes, la corteza y raigañu.[4] Otros nomes populares, en Guatemala: Jocote de micu, Negrín; Olivu; Pasac.
El fervinchu de corteza y raigañu usar pa tratar la malaria, afecciones gastrointestinales (foria, dispepsia atónica, debilidá, amebiasis, merucos, tricocéfalos, vultura), nerviosismu, fiebres intermitentes, tos. La tintura de fueyes tien actividá antiamebiana. Les fueyes machucaes aplíquense tópicamente pal tratamientu d'afecciones cutanees y delles formes de cáncer.[5]
Simarouba amara describióse por Jean Baptiste Christophore Fusée Aublet y espublizóse en Histoire des Plantes de la Guiane Françoise 2: 860–861, pl. 331–332, nel añu 1775.[6]
 Esta páxina forma parte del wikiproyeutu Botánica, un esfuerciu collaborativu col fin d'ameyorar y organizar tolos conteníos rellacionaos con esti tema. Visita la páxina d'alderique del proyeutu pa collaborar y facer entrugues o suxerencies.
Esta páxina forma parte del wikiproyeutu Botánica, un esfuerciu collaborativu col fin d'ameyorar y organizar tolos conteníos rellacionaos con esti tema. Visita la páxina d'alderique del proyeutu pa collaborar y facer entrugues o suxerencies. El aceituno, o Simarouba amara ye una especie d'árbol perteneciente a la familia Simaroubaceae. Alcuéntrase en Florida nos Estaos Xuníos, sur de Méxicu, Centroamérica, y Antilles Mayores. En Cuba denominar aceitillo, en Guatemala y Hondures aceituno o talchocote.
Simarouba amara ist ein Baum in der Familie der Bitterscherengewächse aus dem nördlicheren Süd- und Mittelamerika.
Sehr ähnlich ist die kleinere Simarouba glauca, mit größeren Früchten, Blüten und Antheren, die häufiger zur Fettgewinnung wie für das Holz genutzt wird, und der Gattungsname wird auch oft mit Simaruba geschrieben. Beide Arten werden auch mit „Aceituno“ bezeichnet.
Simarouba amara ist ein schnellwüchsiger, immergrüner, großer Baum der bis etwa 35–40 Meter hoch wächst. Die relativ glatte, feinfurchige Borke ist gräulich oder bräunlich und im Alter leicht rissig.
Die gestielten, wechselständigen Laubblätter sind wechselnd, meist unpaarig, gefiedert mit etwa 9–21 Blättchen. Die kurz gestielten, oberseits glänzenden, kahlen, ledrigen Blättchen sind oft sehr entfernt wechselnd stehend. Sie sind ganzrandig, oft stachelspitzig, verkehrt-eiförmig bis länglich oder elliptisch und an der Spitze abgerundet bis gestutzt und teils eingebuchtet. Sie sind etwa 5–14 Zentimeter lang und unterseits hellgrün bis glauk und schwach bis leicht papillös. Die Nervatur ist gefiedert, mit oberseits undeutlichen Seitenadern.
Simarouba amara ist zweihäusig diözisch. Die eingeschlechtlichen, gestielten und meist fünfzähligen, grün-gelblichen Blüten mit doppelter Blütenhülle stehen in endständigen Rispen. Der becherförmige Kelch ist klein, mit fünf kurzen, breiten Lappen. Die dachziegeligen Kronblätter sind eiförmig und eher gerade. Die männlichen, etwas längeren Blüten besitzen 10 Staubblätter, mit einem haarigen, schuppigen Anhängsel am Grund, in zwei ungleich langen Kreisen und einen kleinen, kissenförmigen und haarigen, reduzierten Pistillode. Die weiblichen Blüten haben einen fünfkammerigen, oberständigen und tieflappigen, auf einem scheibigen Stempelfuß (Gynobasis) stehenden Fruchtknoten mit kurzem, gynobasischem Griffel und fünf, längliche, zurückgelegte Narbenästen sowie kurze, haarige Staminodien.
Es werden Spaltfrüchte an einem Karpophor gebildet. Die einzelnen, ellipsoiden und olivenähnlichen, leicht zweiteiligen und kahlen Steinfrüchte (Merikarpien) sind etwa 1,3–1,7 Zentimeter groß und zur Reife erst gelb bis orange-rötlich und dann schwarzblau. Der große, eiförmige Steinkern ist etwas geadert und hellbraun sowie etwa 1,4 Zentimeter lang.
Aus den Samen wird ein Speisefett erhalten, es kann auch für verschiedene industrielle Anwendung genutzt werden. Es kann als Kakaobutteräquivalent verwendet werden.
Die essbare Fruchtpulpe wird zu Getränken verarbeitet. Die Samen- bzw. Steinschalen können z. B. als Aktivkohle verwendet werden.
Die Rinde (Wurzelrinde; Cortex Simaroubae) und die Blätter können medizinisch genutzt werden.
Das helle, leichte und weiche, nicht sehr beständige Holz wird als Resonanzboden in Streichinstrumenten verwendet. Auch kann es für verschiedene andere Anwendung genutzt werden oder für Streichhölzer. Es ist bekannt als Simar(o)uba oder Marupá.
Simarouba amara ist ein Baum in der Familie der Bitterscherengewächse aus dem nördlicheren Süd- und Mittelamerika.
Sehr ähnlich ist die kleinere Simarouba glauca, mit größeren Früchten, Blüten und Antheren, die häufiger zur Fettgewinnung wie für das Holz genutzt wird, und der Gattungsname wird auch oft mit Simaruba geschrieben. Beide Arten werden auch mit „Aceituno“ bezeichnet.
लक्ष्मी तरु मुलत: उत्तरी अमेरिका का पेड़ है। इसके बीजों से खाद्य तेल बनता है तथा अन्य भाग भी बहुत उपयोगी हैं। भारत में श्री श्री रवि शंकर जी इसे घर-घर में लगाने का अभियान चला रहे हैं। इसे "स्वर्ग का पेड़" (पैराडाइज ट्री) कहा जाता है।
[[श्रेणी:पेड़] हेल्थ कैंसर से निजात दिलाएगा लक्ष्मी तरु: डॉ. जीएल बांसल आर्टऑफ़ लिविंग द्वारा मानवता के लिए वरदान लक्ष्मी तरु पेड़ का पौधरोपण बठिंडा में किया गया। आर्ट ऑफ़ लिविंग के टीचर... कैंसर से निजात दिलाएगा लक्ष्मी तरु: डॉ. जीएल बांसल Bhaskar News Network Jul 18, 2016, 04:05 AM IST आर्टऑफ़ लिविंग द्वारा मानवता के लिए वरदान लक्ष्मी तरु पेड़ का पौधरोपण बठिंडा में किया गया।
आर्ट ऑफ़ लिविंग के टीचर संदीप अग्रवाल ने बताया कि संस्था की ओर से बंगलौर आश्रम से विशेष तौर पर पधारे डॉ. जीएल बांसल ने कृषि विज्ञान केंद्र में पौधरोपण किया। लक्ष्मी तरु वृक्ष की महत्ता बताते हुए डॉ. बंसल ने बताया कि यह पेड़ 2006 में आर्ट ऑफ़ लिविंग के संस्थापक श्रीश्री रवि शंकर जी तत्कालीन राष्ट्रपति डॉ. अब्दुल कलाम द्वारा लगाया गया। इस पेड़ के पत्तों से जहां सेकंड स्टेज तक के कैंसर का खात्मा संभव है, वहीं आंखों के रोग, एनीमिया, अंदरूनी फोड़ा, रक्तस्राव, पाचन प्रणाली, गैस एसिडिटी, हाइपर एसिडिटी, डायरिया, कोलाइटिस, चिकन गुनिया, हेपेटाइटिस, मलेरिया, फीवर, मासिक धर्म, सफेद पानी समेत अनेक रोगों को भी बहुत जल्द ठीक करता है। लक्ष्मी तरु पेड़ की कुछ पत्तियां मात्र एक कप पानी में उबाल कर खाली पेट पानी पीना होता है। अब तक आर्ट ऑफ़ लिविंग की ओर देश भर में लक्ष्मी तरु के 20 लाख से अधिक पौधे लगाए जा चुके है और यह क्रम निरंतर जारी है।
आर्ट ऑफ़ लिविंग के सतीश जिंदल ने बताया कि बठिंडा में भी कई जगह पर लक्ष्मी तरु के पौधे लगाए जाएंगे और लोगों को इनसे मिलने वाले लाभ के बारे में जागरूक किया जाएगा। कृषि विज्ञान केंद्र डिविजनल फारेस्ट अफसर डॉ. संजीव तिवारी ने भी लक्ष्मी तरु पेड़ ज्यादा से ज्यादा लगाने का भरोसा दिया है। लक्ष्मी तरु के पौधे लेने के इच्छुक आर्ट ऑफ़ लिविंग के किसी भी कार्यकर्ता से संपर्क कर सकते हैं। इस अवसर पर पर रमन अग्रवाल, संजीव गर्ग, दिनेश गोयल, अमित जैन, सुमित अरोड़ा अन्य कार्यकर्ता उपस्थित थे।
लोगों को लक्ष्मी तरु के पौधे वितरित करते आर्ट आफ लिविंग के मेंबर
लक्ष्मी तरु मुलत: उत्तरी अमेरिका का पेड़ है। इसके बीजों से खाद्य तेल बनता है तथा अन्य भाग भी बहुत उपयोगी हैं। भारत में श्री श्री रवि शंकर जी इसे घर-घर में लगाने का अभियान चला रहे हैं। इसे "स्वर्ग का पेड़" (पैराडाइज ट्री) कहा जाता है।
Simarouba amara is a species of tree in the family Simaroubaceae, found in the rainforests and savannahs of South and Central America and the Caribbean. It was first described by Aubl. in French Guiana in 1775 and is one of six species of Simarouba. The tree is evergreen, but produces a new set of leaves once a year. It requires relatively high levels of light to grow and grows rapidly in these conditions, but lives for a relatively short time. In Panama, it flowers during the dry season in February and March, whereas in Costa Rica, where there is no dry season it flowers later, between March and July. As the species is dioecious, the trees are either male or female and only produce male or female flowers. The small yellow flowers are thought to be pollinated by insects, the resulting fruits are dispersed by animals including monkeys, birds and fruit-eating bats and the seeds are also dispersed by leaf cutter ants.
Simarouba amara has been studied extensively by scientists in an attempt to understand the tree and also to gain a better understanding of the ecology of the rainforest in general. Many of these studies were conducted on Barro Colorado Island in Panama or at La Selva Biological Station in Costa Rica. Of particular interest is how it competes with other species and with individuals of the same species at different stages in its life cycle. The seedlings are normally limited by the amount of light and nutrients found where they are growing and the saplings are considered relatively light demanding compared to other species. Young individuals are more likely to survive when they grow further away from their parents and when there are few other individuals growing near to them, which may be due to them being able to escape diseases. Plant physiologists have investigated how the leaves of the tree differ depending on their location in the forest canopy finding they are thicker in the canopy and thinner in the understory. They have also measured how the water potential of their leaves changes and when their stomata open and close during the day; the findings suggest that rather than closing their stomata to control water loss, it is controlled by the leaf area instead. Population geneticists have examined the way in which its genes vary, at both the local scale and across its range using microsatellites. It is genetically diverse, indicating gene flow occurs between populations and seeds can be dispersed up to 1 km. The leaves of S. amara are eaten by several species of caterpillar, particularly those in the genus Atteva. Several species of termite and ants live on or around the tree and lianas and epiphytes grow on the tree.
The bark of S. amara has been used by people in its range to treat dysentery and diarrhea, as well as other diseases, and was also exported to Europe in the eighteenth century to treat these illnesses. A number of compounds have since been isolated from the bark and have been shown to have antimicrobial effects. Local people use the wood of the tree for various purposes and it is also grown in plantations and harvested for its timber, some of which is exported.
Simarouba amara grows to heights of up to 35 metres, with a maximum trunk diameter of 125 cm and a maximum estimated age of 121 years.[5][6][7] It has compound leaves that are each around 60 cm long, the petioles are 4–7 cm long and each leaf has 9–16 leaflets. Each leaflet is 2.5–11 cm long and 12–45 mm wide, with those towards the end of the compound leaf tending to be smaller. The flowers occur on a staminate panicle that is around 30 cm in length, which is widely branched and densely covered in flowers.[8] The flowers are unisexual, small (<1 cm long) and pale yellow in colour. They are thought to be pollinated by insects such as small bees and moths. On Barro Colorado Island (BCI), Panama, it tends to flower during the dry season from the end of January to the end of April, persisting for 11 to 15 weeks each year.[5] In Costa Rica, it flowers slightly later, between March and July, peaking in April.[9] Fruits form between 1 and 3 months after pollination occurs. The fruits are brightly colored green to purplish-black, approximately 17 mm long and contain large seeds (10–14 mm), they occur in groups of 3–5 drupes. The seeds cannot stay dormant and are dispersed by vertebrates.[5] Each seed weighs approximately 0.25 g.[6]
It is an evergreen species, with a new flush of leaves growing between January and April, during the dry season, when the highest light levels occur in the rainforest. This phenology is thought to allow S. amara to photosynthesise most effectively, since the new leaves are more efficient than those they replace.[7][9] It has visible, but indistinct growth rings that are on average 7 mm wide.[7] A study of individuals in Panama found that they grow on average 8.4 mm in diameter each year,[10] in Costa Rica, growth rates as fast as 18 mm per year have been recorded, and the stem grows constantly throughout the year.[9] The xylem vessels in mature trees range from 20 to 90 μm in diameter, with around 50 vessels present per mm2 of branch.[11] The density of the wood is between 0.37–0.44 g/cm3,[6] lower than many other species in the rainforest.[12]
It is a fast-growing, light-demanding and shade-intolerant species. Saplings are typically one straight pole, with several compound leaves and only one point of growth. This allows the sapling to achieve the greatest vertical growth with a minimum amount of biomass.[13] They start to branch once they are 2–5 m tall.[14]
A study in the forest dynamics plot on BCI found that between 1982 and 2000, around 65% of individuals died, with mortality highest amongst small individuals (<1 cm dbh). Large trees (>20 cm dbh) are relatively rare, averaging 2.4 trees per hectare, compared to 40 trees per hectare of>1 cm dbh.[5]
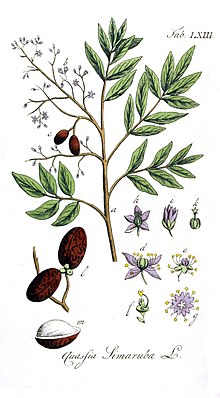
Simarouba amara was first described by Jean Baptiste Christophore Fusée Aublet in French Guiana in 1775 and is the type species of the genus Simarouba.[1][2] In 1790, William Wright described Quassia simarouba,[15] which Auguste Pyrame DeCandolle suggested was the same species as S. amara. However, because S. amara was described as monoecious by Aublet and Q. simarouba was described as dioecious by Wright, they were still regarded as separate species in 1829.[16] By 1874, when the Flora Brasiliensis was published, they were considered synonymous.[17]
Among the six species of Simarouba, two besides S. amara occur on the continent: S. glauca and S. versicolor. S. amara can be distinguished from the other continental species by having smaller flowers, anthers and fruit, and straight, rather than curved petals.[18] The leaves of Simarouba amara subsp. opaca are not glaucous (a bluish-grey or green colour) on their underside, whereas those of Simarouba amara subsp. typica are.[2]
Simarouba amara is known by many common names, where in the Neotropics. In Bolivia it is known as chiriuana, in Brazil as marupa, marupuaba, parahyba, paraiba and tamanqueira. In Colombia it is called simaruba, in Ecuador as cedro amargo, cuna and guitarro, in French Guiana as simarouba, in Guyana as simarupa, in Peru as marupa, in Surinam as soemaroeba and in Venezuela cedro blanco and simarouba.[19]
In Europe, it was known by various names during the nineteenth century when it was used as a medicine; these names included bitter ash,[20] bitterwood,[19] mountain damson[21] and stave-wood.[22]
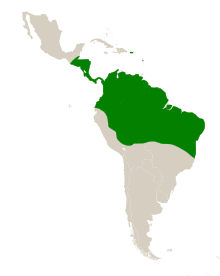
The natural range of S. amara is in the Neotropics, the ecoregion of Central and South America. Its range extends from Guatemala in the north, to Bolivia in the south and from Ecuador in the west, to the east coast of Brazil.[18] It has been introduced to the islands of Dominica and Puerto Rico in the Caribbean Sea, becoming naturalised in Puerto Rico.[23][24] On BCI, mature trees (>10 cm dbh) are found at a frequency of 5 per hectare, in Ecuador at 0.7 per hectare and in French Guiana at 0.4 per hectare. Genetic analysis of populations suggests that it has always been relatively common within its range.[25] It grows in rainforests and in savannahs.[26] The seedlings of S. amara are rare in primary forest due to their light-demanding habit.[13]
Populations of S. amara display high levels of heterozygosity indicating that it is genetically diverse. This is consistent with the tree outcrossing over large distances by long-distance pollen flow and that there has been sufficient long distance gene flow between populations to counteract the effects of genetic drift. A study of 478 plants from 14 populations across South America found that 24% of all alleles occurred in only one population.[25] A study of 300 plants on Barro Colorado Island found that the heterozygosity at 5 microsatellite loci varied between 0.12 and 0.75. 8 out of the 50 alleles scored occurred in only one plant.[5]
Individuals do not typically reproduce until they have a trunk diameter of 30 cm. Once mature, the trees produce flowers each year, but not all females produce fruit each year.[5] Their flower morphology is typical of being pollinated by generalist small insects such as bees and moths.[5] It has been reported to be pollinated by non-sphingid moths,[27] but other authors have questioned whether this is correct.[28]

The seeds of S. amara are dispersed by vertebrates, mainly large birds and mammals, including chachalacas, flycatchers, motmots, thrushes, howler monkeys, tamarins[29] and spider monkeys. Leaf cutter ants have also been observed to disperse the seeds and dense seedling carpets form in areas where they dump waste material[5] but most of the seedlings die and dispersal by the ants is thought to be unimportant in determining the long-term patterns of recruitment and dispersal.[30] Seeds that are eaten by monkeys are more likely to germinate than seeds that have not.[31] Fruit-eating phyllostomid bats have also been noted to disperse their seeds; this may aid the regeneration of forests as they disperse the seeds of later successional species while they feed on S. amara.[32]
Based on inverse modelling of data from seed traps on BCI, the estimated average dispersal distance for seeds is 39 m.[5] Studying seedlings and parent trees on BCI using DNA microsatellites revealed that, in fact on average, seedlings grow 392 m away from their parents, with a standard deviation of ±234 m and a range of between 9 m and 1 km. In the forest there are many seeds and seedlings beneath reproductive females; genetic data indicate that seedlings are unlikely to be from nearby adults, but rather dispersed there by vertebrates that have fed on one tree and then moved to feed on another, defecating while in the canopy and depositing the seeds.[29]
Various aspects of the physiology or S. amara have been studied. The stomatal conductance of the leaves, an indication of the rate at which water evaporates, of mature trees at midday range from 200 to 270 mmol H2O m−2 s−1. The leaf water potentials at midday range from −0.56 to −1.85 MPa, averaging around −1.2 MPa. Cavitation is widespread in the trunk and the stomata do not close before cavitation occurs. Although this would normally be considered deleterious to the tree, it may buffer the leaf water potential and therefore be beneficial. The stomatal conductance and hydraulic conductance of the branches of taller trees (~30 m) are much higher than in the branches of smaller trees (~20 m). Phillips, Bond and Ryan suggested that this is probably due to the branches of taller trees having a lower leaf-to-sapwood ratio than those of small branches. Dye staining shows that cavitation is common in the branches of S. amara. They concluded that water flux in S. amara is controlled by structural (leaf area), rather than physiological (closing stomata) means.[11]
Leaves absorb light in the photosynthetically active radiation (PAR) spectrum at wavelengths between 400 nm and 700 nm with a high efficiency, but the efficiency decreases at longer wavelengths. Generally plants absorb PAR at efficiencies of around 85%; the higher values found in S. amara are thought to be due to the high humidity of its habitat. The reflectance and transmittance of the leaves are low at between 400 and 700 nm. The optical properties and the mass of the leaves vary depending on their location in the forest canopy, with leaves becoming thicker and more efficient as their height within the canopy increases. For their weight, however, leaves in the understory are more efficient at capturing light than leaves in the canopy.[33]
The concentration of bioavailable phosphate has been found to be higher underneath female individuals than underneath males, even though the total concentration of phosphate is equal. Rhoades et al. concluded that this difference was due to females changing the availability of phosphate, rather than females only growing in areas with high phosphate availability. This is thought to be caused either by the fruit containing high levels of phosphate which would fall off the tree and rot, or by the fruits attracting animals which deposit phosphate beneath the females. It is also possible that the sexes produce different root exudates, which affect the microbial community in their rhizosphere, thereby affecting phosphate availability.[34]
The woody tissues of S. amara have been found to respire at a rate of 1.24 μmol CO2 m−2 s−1, and this rate of respiration correlates positively with the growth rate of the stem. Maintenance respiration was calculated at 31.1 μmol CO2 m−3 s−1 and this rate correlated positively with the sapwood volume.[35]
Experiments on BCI where trenches were dug around seedlings of S. amara, or where gaps in the canopy were made above them, show that their relative growth rate can be increased by both. This shows that their growth is normally limited by both above-ground competition for light and by below-ground competition for nutrients and water. Competition for light is normally more important, as shown by the growth rate increasing by almost 7 times and mortality decreasing, when seedlings were placed in gaps, compared to the understory. When seedlings in gaps had a trench dug round them to prevent below-ground competition their growth increased further, by 50%, demonstrating that in gaps the seedlings are limited by below-ground competition. Trenching around seedlings in the understory did not significantly increase their growth, showing that they are normally only limited by competition for light.[36]
Larger seedlings are more likely to survive the dry season on BCI than smaller seedlings.[37] Density-dependent inhibition occurs between seedlings: they are more likely to survive in areas where fewer seedlings of S. amara are growing. A study on individuals on BCI found that this pattern may be caused by differences in soil biota rather than by insect herbivores or fungal pathogens.[37] Observations based on the distance of seedlings from their parents indicate that the Janzen-Connell hypothesis applies to seedlings of S. amara: they are more likely to survive away from their parents as they escape pests such as herbivores and plant pathogens which are more common underneath the parent trees.[29]
Saplings of S. amara are light demanding and are found in brighter areas of the rainforest compared to Pitheullobium elegans and Lecythis ampla seedlings. A study at the La Selva Biological Station found the leaves weigh approximately 30 g/m2 (dry weight), similar to P. elegans, but around double the weight of L. ampla. The photosynthetic capacity of the leaves of S. amara is higher than that of the other two species, averaging around 6 μmol m−1 s−1. Dark respiration is on average 0.72 μmol m−1 s−1, higher than that of the other two species. The maximum photosynthetic rate correlates with both stem diameter and vertical growth. Diffuse light is thought to be more important for seedling growth than sunflecks.[13] Another study of saplings at La Selva found that they grew 7 cm yr−1 in height and 0.25 mm yr−1 in diameter. On average they had nine compound leaves, a leaf area index of 0.54 and the total surface area of their leaves was 124 cm2. The saplings that had the lowest leaf area were most likely to die during the study and those with a larger leaf area grew faster than other saplings.[14]
A study of saplings between one and four centimeters in diameter on BCI found that the growth of saplings did not vary depending on which species grew near them, contrary to predictions that density-dependence inhibition occurs. A model based on these findings predicted that saplings with a diameter of 2 cm are able to grow at a maximum rate of 13 mm yr−1 and that if another tree with a diameter of 10 cm is growing within 5 m of the sapling, its growth is only reduced to 12 mm yr−1, indicating that they are not affected by crowding. Trees growing more than 15 m away from a sapling do not affect their growth.[38]
Lianas are relatively rare on mature (>20 cm dbh) individuals of S. amara, compared to other trees on BCI, with only around 25% having lianas growing on them. Putz suggested that this may be due to the trees having large leaves, but the mechanism by which this would reduce the number of lianas is unknown.[10] Smaller individuals also have fewer lianas and woody hemi-epiphytes than other species of tree in the same forests.[39]
The ailanthus webworm (Atteva aurea) and other members of the genus Atteva have been recorded to eat the new shoot tips of S. amara in Costa Rica.[40] The larvae of the butterfly species, Bungalotis diophorus feed exclusively on saplings and treelets of S. amara.[41] Two termite species have been observed living on S. amara in Panama, Calcaritermes brevicollis in dead wood and Microcerotermes arboreus nesting in a gallery on a branch.[42] Bullet ants (Paraponera clavata) have been found to nest at the base of S. amara trees.[43] The Hemiptera, Enchophora sanguinea (Fulgoridae) has been found preferentially on the trunks of S. amara.[44][45]
Simarouba amara is used locally for producing paper, furniture, plywood and matches and is also used in construction.[5] It is also grown in plantations, as its bright and lightweight timber is highly sought after in European markets for use in making fine furniture and veneers.[6][46] The wood dries rapidly and is easy to work with normal tools. It is creamy white to light yellow in colour, with a coarse texture and a straight grain. It has to be treated to prevent fungi, wood borers and termites from eating it. The heartwood has a density of 0.35–0.45 g/cm3.[19] It has been noted to be one of the best species for timber that can be grown in the Peruvian Amazon, along with Cedrelinga catenaeformis, due to its rapid growth characteristics.[47] The Worldwide Fund for Nature recommend that consumers ensure S. amara timber is certified by the Forest Stewardship Council so that they do not contribute to deforestation.[48] Wood shavings of S. amara have been used in animal bedding leading to the poisoning of horses and dogs.[49]
The leaves and bark of S. amara have been used as an herbal medicine to treat dysentery, diarrhea, malaria and other illnesses in areas where it grows. In 1713, it was exported to France where it was used to treat dysentery, being an effective treatment during epidemics between 1718 and 1725. In 1918 its effectiveness was validated by a study where soldiers in a military hospital were given a tea made of the bark to treat amoebic dysentery. In a 1944 study, the Merck Institute found it was 92% effective at treating intestinal amoebiasis in humans. During the 1990s, scientists demonstrated it could kill the most common cause of dysentery, Entamoeba histolytica, and species of Salmonella and Shigella bacteria that cause diarrhea.[50] A greater amount of evidence is required to prove the efficacy of Simarouba.
The main biologically active compounds found in S. amara are the quassinoids, a group of triterpenes including ailanthinone, glaucarubinone, and holacanthone. These have been reported to kill protozoa, amoeba, Plasmodium (the cause of malaria). The antimalarial properties were first investigated by scientists in 1947; they found that in chickens, 1 mg of bark extract per 1 kg of body weight had strong antimalarial activity. In 1997 a patent was filed in the United States for using an extract in a skin care product.[50] Simarouba amara is not to be confused with Simarouba glauca, which is known as Lakshmi Taru in India.
{{cite web}}: CS1 maint: multiple names: authors list (link) Simarouba amara is a species of tree in the family Simaroubaceae, found in the rainforests and savannahs of South and Central America and the Caribbean. It was first described by Aubl. in French Guiana in 1775 and is one of six species of Simarouba. The tree is evergreen, but produces a new set of leaves once a year. It requires relatively high levels of light to grow and grows rapidly in these conditions, but lives for a relatively short time. In Panama, it flowers during the dry season in February and March, whereas in Costa Rica, where there is no dry season it flowers later, between March and July. As the species is dioecious, the trees are either male or female and only produce male or female flowers. The small yellow flowers are thought to be pollinated by insects, the resulting fruits are dispersed by animals including monkeys, birds and fruit-eating bats and the seeds are also dispersed by leaf cutter ants.
Simarouba amara has been studied extensively by scientists in an attempt to understand the tree and also to gain a better understanding of the ecology of the rainforest in general. Many of these studies were conducted on Barro Colorado Island in Panama or at La Selva Biological Station in Costa Rica. Of particular interest is how it competes with other species and with individuals of the same species at different stages in its life cycle. The seedlings are normally limited by the amount of light and nutrients found where they are growing and the saplings are considered relatively light demanding compared to other species. Young individuals are more likely to survive when they grow further away from their parents and when there are few other individuals growing near to them, which may be due to them being able to escape diseases. Plant physiologists have investigated how the leaves of the tree differ depending on their location in the forest canopy finding they are thicker in the canopy and thinner in the understory. They have also measured how the water potential of their leaves changes and when their stomata open and close during the day; the findings suggest that rather than closing their stomata to control water loss, it is controlled by the leaf area instead. Population geneticists have examined the way in which its genes vary, at both the local scale and across its range using microsatellites. It is genetically diverse, indicating gene flow occurs between populations and seeds can be dispersed up to 1 km. The leaves of S. amara are eaten by several species of caterpillar, particularly those in the genus Atteva. Several species of termite and ants live on or around the tree and lianas and epiphytes grow on the tree.
The bark of S. amara has been used by people in its range to treat dysentery and diarrhea, as well as other diseases, and was also exported to Europe in the eighteenth century to treat these illnesses. A number of compounds have since been isolated from the bark and have been shown to have antimicrobial effects. Local people use the wood of the tree for various purposes and it is also grown in plantations and harvested for its timber, some of which is exported.
Simarouba amara, llamada comúnmente aceituno, es una especie arbórea perteneciente a la familia Simaroubaceae. Se encuentra en Florida en los Estados Unidos, sur de México, Centroamérica, y Antillas Mayores.[1]
Son árboles o arbustos, que alcanzan un tamaño de 3–30 m de alto; plantas dioicas. Las hojas imparipinnadas, de 10–30 cm de largo, con 6–18 folíolos, obovados, de 3–9 cm de largo y 1–3 cm de ancho, redondeados a emarginados en el ápice, acuminados a agudos en la base, generalmente verde obscuros o verde olivos en la haz, amarillo-verdosos y más claros en el envés. Las panículas de 10–30 cm de largo, flores unisexuales, sépalos 5, 1 mm de largo, verdes o verde olivos; pétalos 5, 4–7 mm de largo, generalmente amarillos pero frecuentemente con matices verdes o rojos; estambres 10, filamentos 1–2.5 mm de largo, con un apéndice en la base, anteras 1–1.5 mm de largo, muy reducidas en las flores pistiladas; gineceo 5-carpelar y 5-locular, estigmas libres. Drupas 1–5, comprimidas, elíptico-lenticulares, 1.5–2 cm de largo y 1–1.5 cm de ancho, anaranjadas o rojas al madurarse.
Común en lugares abiertos y bosques caducifolios, zonas del pacífica y atlántica a una altitud de 0–500 metros; desde Belice a Brasil y en las Antillas. Existen dos formas de esta especie: una que corresponde al tipo de S. amara y es un árbol grande de bosques, con pétalos y anteras más pequeños; y la otra forma, típica de ambientes abiertos, es un árbol más pequeño, con pétalos y anteras ligeramente más grandes y es representativo del taxón llamado S. glauca. La dificultad de asignar todos los especímenes a una de estas dos especies descritas además de la existencia de numerosas formas intermedias, son argumentos para unir estos nombres bajo una sola especie.
Sus semillas producen un aceite comestible. El árbol es muy adecuado para el clima cálido y las regiones tropicales húmedas. Su cultivo depende de la distribución de las precipitaciones, la capacidad de retención de agua del suelo y la humedad del subsuelo. Es adecuado para temperaturas de 10 a 40 ° C . Puede crecer a alturas desde el nivel del mar a 1000 msnm. Alcanza un tamaño de 12 a 15 m de altura y tiene una envergadura de 7,6 a 9,1 m. Tiene flores de color amarillo y la fruta carnosa forma de óvalo alargado de color púrpura.
Puede propagarse por semillas, injertos y cultivo de tejidos tecnológicos. Los frutos se recogen en el mes de abril / mayo, cuando están maduras y se secan al sol durante una semana. La piel se separa y se cultivan dichas semillas en bolsas de plástico para producir plantones, a los 2 - 3 meses de edad los árboles jóvenes puede ser trasplantado a una plantación.
El árbol forma un robusto sistema de raíces y follaje siempre verde denso que controla de manera eficiente la erosión del suelo, es compatible con la vida microbiana del suelo, y mejora la posición de las aguas subterráneas. Además de la conversión de energía solar en energía bioquímica durante todo el año, se comprueba el sobrecalentamiento de la superficie del suelo durante todo el año y especialmente durante el verano. La plantación a gran escala en terrenos baldíos facilita la recuperación de tierras baldías, convierte la acumulación atmosférica de dióxido de carbono en oxígeno y contribuye a la reducción del efecto invernadero o calentamiento global.
Del aceituno:[2] se utilizan las hojas, la corteza y raíz.[3] Otros nombres populares, en Guatemala: Jocote de mico, Negrito; Olivo; Pasac.
La infusión de corteza y raíz se usa para tratar la malaria, afecciones gastrointestinales (diarrea, dispepsia atónica, debilidad, amebiasis, lombrices, tricocéfalos, vómito), nerviosismo, fiebres intermitentes, tos. La tintura de hojas tiene actividad antiamebiana. Las hojas machacadas se aplican tópicamente para el tratamiento de afecciones cutáneas y algunas formas de cáncer.[4]
Simarouba amara fue descrita por Jean Baptiste Christophore Fusée Aublet y publicado en Histoire des Plantes de la Guiane Françoise 2: 860–861, pl. 331–332, en el año 1775.[5]
En Cuba se denomina aceitillo[7] o palo blanco,[8] en Guatemala y Honduras aceituno o talchocote.[7]
Simarouba amara, llamada comúnmente aceituno, es una especie arbórea perteneciente a la familia Simaroubaceae. Se encuentra en Florida en los Estados Unidos, sur de México, Centroamérica, y Antillas Mayores.
Simarouba amara est une espèce d'arbre de la famille des Simaroubaceae, présente dans les forêts tropicales et les savanes d' Amérique du Sud et centrale et des Caraïbes. Il a été décrit pour la première fois par Aublet en Guyane française en 1775[4] et est l'une des six espèces de Simarouba. L'arbre est à feuilles persistantes, mais produit une nouvelle série de feuilles une fois par an. Il nécessite beaucoup de lumière pour se développer et se développe rapidement dans ces conditions, mais vit pendant une période relativement courte. Au Panama, il fleurit pendant la saison sèche en février et mars, tandis qu'au Costa Rica, où il n'y a pas de saison sèche, il fleurit plus tard, entre mars et juillet. Comme l'espèce est dioïque, les arbres sont mâles ou femelles et ne produisent que des fleurs mâles ou femelles. On pense que les petites fleurs jaunes sont pollinisées par des insectes, les fruits qui en résultent sont dispersés par des animaux, notamment des singes, des oiseaux et des chauves-souris frugivores, et les graines sont également dispersées par les fourmis coupeuses de feuilles .
Simarouba amara a été largement étudié par les scientifiques dans le but de comprendre l'arbre et également d'acquérir une meilleure compréhension de l'écologie de la forêt tropicale en général. Beaucoup de ces études ont été menées sur l'île de Barro Colorado (BCI) au Panama ou à la station biologique de La Selva au Costa Rica. Il est particulièrement intéressant de savoir comment il entre en compétition avec d'autres espèces et avec des individus de la même espèce à différents stades de son cycle de vie. Les semis sont normalement limités par la quantité de lumière et de nutriments trouvés là où ils poussent et les gaules sont considérées comme relativement exigeantes en lumière. Les jeunes individus ont plus de chances de survivre lorsqu'ils s'éloignent de leurs parents et lorsqu'il y a peu d'autres individus qui poussent près d'eux, ce qui peut être dû à leur capacité à échapper aux maladies. Les physiologistes des plantes ont étudié comment les feuilles de l'arbre diffèrent en fonction de leur emplacement dans la canopée forestière, trouvant qu'elles sont plus épaisses dans la canopée et plus minces dans le sous-bois. Ils ont également mesuré comment le potentiel hydrique de leurs feuilles change et quand leurs stomates s'ouvrent et se ferment pendant la journée; les résultats suggèrent que plutôt que de fermer leurs stomates pour contrôler la perte d'eau, elle est plutôt contrôlée par la surface foliaire. Les généticiens des populations ont examiné la manière dont ses gènes varient, à la fois à l'échelle locale et dans son aire de répartition, à l' aide de microsatellites. Il est génétiquement diversifié, ce qui indique que le flux génétique se produit entre les populations et que les graines peuvent être dispersées jusqu'à 1 km. Les feuilles de S. amara sont mangés par plusieurs espèces de chenilles, en particulier celles du genre Atteva . Plusieurs espèces de termites et de fourmis vivent sur ou autour de l'arbre et des lianes et des épiphytes poussent sur l'arbre.
L'écorce de S. amara a été utilisé pour traiter la dysenterie et la diarrhée, ainsi que d'autres maladies, et a également été exportée vers l'Europe au XVIIIe siècle pour traiter ces maladies. Un certain nombre de composés ont depuis été isolés de l'écorce et se sont avérés avoir des effets antimicrobiens. Les populations locales utilisent le bois de l'arbre à des fins diverses et il est également cultivé dans des plantations et récolté pour son bois, dont une partie est exportée.
Simarouba amara atteint des hauteurs allant jusqu'à 35 mètres, avec un diamètre maximal du tronc de 125 cm et un âge maximum estimé à 121 ans.[5],[6],[7] Il a des feuilles composées d'environ 60 cm de long, les pétioles mesurent 4–7 cm de long et chaque feuille a 9–16 folioles. Chaque dépliant est de 2,5 à 11 cm de long et 12–45 mm de large, celles vers l'extrémité de la feuille composée ayant tendance à être plus petites. Les fleurs se produisent sur une panicule staminée d'environ 30 cm de longueur, largement ramifié et densément couvert de fleurs.[8] Les fleurs sont unisexuées, petites (<1 cm de long) et de couleur jaune pâle. On pense qu'ils sont pollinisés par des insectes tels que des petites abeilles et des papillons de nuit . Sur l'île Barro Colorado, au Panama, il a tendance à fleurir pendant la saison sèche de fin janvier à fin avril, persistant pendant 11 à 15 semaines chaque année. Au Costa Rica, il fleurit un peu plus tard, entre mars et juillet, avec un pic en avril[9]. Les fruits se forment entre 1 et 3 mois après la pollinisation. Les fruits sont de couleur vert vif à noir violacé, ont environ 17 mm de long et contiennent de grosses graines (10–14 mm), ils se présentent en groupes de 3 à 5 drupes. Les graines ne peuvent pas rester dormantes et sont dispersées par les vertébrés. Chaque graine pèse environ 0,25 g.
C'est une espèce à feuilles persistantes, avec une nouvelle poussée de feuilles qui pousse entre janvier et avril, pendant la saison sèche, lorsque les niveaux de lumière les plus élevés se produisent dans la forêt tropicale. On pense que cette phénologie permet à S. amara d'optimiser sa photosynthèse, car les nouvelles feuilles sont plus efficaces que celles qu'elles remplacent[7],[9]. Il a des anneaux de croissance visibles, mais indistincts qui ont en moyenne 7 mm de large. Une étude sur des individus au Panama a révélé qu'ils grandissaient en moyenne de 8,4 mm de diamètre chaque année[10], au Costa Rica, des taux de croissance jusque 18 mm par an ont été enregistrés, et la tige pousse constamment tout au long de l'année. Les vaisseaux du xylème dans les arbres matures vont de 20 à 90 μm de diamètre, avec environ 50 vaisseaux présents par mm2 de branche[11]. La densité du bois est comprise entre 0,37 et 0,44 g/cm 3[6], inférieure à celle de nombreuses autres espèces de la forêt tropicale[12].
C'est une espèce à croissance rapide, exigeante en lumière et intolérante à l'ombre . Les jeunes arbres sont généralement un pôle droit, avec plusieurs feuilles composées et un seul point de croissance. Cela permet au jeune arbre d'obtenir la plus grande croissance verticale avec une quantité minimale de biomasse[13]. Ils commencent à se ramifier une fois qu'ils ont 2 à 5 m de haut[14].
Une étude du diagramme de dynamique forestière sur l'île a révélé qu'entre 1982 et 2000, environ 65% des individus sont morts, la mortalité étant la plus élevée parmi les petits individus (<1 cm dhp ). Les grands arbres (> 20 cm dhp) sont relativement rares, avec en moyenne 2,4 arbres par hectare, contre 40 arbres par hectare de> 1 cm dbh[5].
En 1775, le botaniste Aublet propose la diagnose suivante[15] :
« "SIMAROUBA amara.. (TABULA 331 & 331.)
Euonymus fructu nigro, tetragono, vulgo Simarouba. Barr. Fran. Equinox.
Arbor trunco ſexaginta-pedali, ad ſummitatem ramoſo ; RAMIS longis, late & undique ſparſis ; ramulis folioſis. Folia alterna, pinnata, foliolis utrinque binis, quatuor uſque ad novem, ovatis, acutis, glabris, rigidis, integerrimis, ſubſeſſilibus, utrinque alternatim coſtæ cylindraceæ in acumen longum deſinenti adnexis. Flores in amplas paniculas diſpoſiti, axillares & terminales. Ramis, ramuſculis & pedunculis florum, ad baſim ſquamula munitis. E floribus alii ſunt malculi, alii ſeminei, in câdem panicula.
Cortex trunci & radicum inciſus, ladeum & amarum ſuccum eſſundit : lignum leve, album, amareſcit ; horum decoctum uſurpatur ad dyſenterias ſanandas.
Floret Novembri & Decembri ; fructum ſert maturum Martio & Aprili.
Habitat locis arenoſis Caiennæ & Guianæ, & in inſulâ Sandominicanâ, loco dicto Mirebalais, & in via quæ ducit à Jambrabel ad portum pacis.
Nomen Caribæam simarouba. »
« LE SIMAROUBA amer. (PLANCHE 331-332.)
Le tronc de cet arbre a ſoixante pieds de hauteur & plus, ſur deux pieds & demi de diamètre. Son écorce eſt liſſe, griſâtre. Son bois eſt léger, blanchâtre & peu compacte. Il pouſſe à ſon ſommet de groſſes & longues branches éparſes, les unes droites, les autres inclinées, chargées à leur extrémité, de rameaux garnis de feuilles alternes, & ailées à deux rangs de folioles alternes. Le nombre de ces folioles varie ; l'on en compte depuis deux juſqu'à neuf ſur chaque rang. La côte ſur laquelle elles ſont attachées, eſt cylindrique, renflée par le bas : elle eſt terminée par une longue pointe. La côte des plus grandes feuilles eſt longue de quatorze pouces.
Les folioles ſont ovales, liſſes, fermes, vertes en deſſus, & plus pâles en deſſous. A leur extrémité ſupérieure, la nervure qui les partage, forme une petite pointe charnue. Leur pédicule eſt court & cylindrique. On a repréſenté une Foliole de grandeur naturelle.
Les fleurs ſont les unes mâles, & les autres femelles. Elles naiſſent entremêlées ſur des panicules rameuſes & éparſes. Les rameaux ont au deſſous de leur naiſſance une foliole fort courte, & les pédoncules de chaque fleur ont une petite écaille. La fleur eſt très petite.
Les fleurs mâles ont le calice d'une ſeule pièce ; il eſt charnu & à cinq petites dentelures.
La corolle eſt à cinq pétales, roides, fermes, aigus, blanchâtres, attachés entre un diſque membraneux, & le calice, au deſſous de ſes divisions.
Les étamines ſont au nombre de dix, portées ſur le diſque qui entoure l'ovaire. Leurs filets ſont courts, garnis chacun à leur baſe interne d'une petite écaille arrondie & velue. Les anthères ſont oblongues, attachées par leur dos, & ſéparées en deux bourſes par un ſillon.
Le piſtil, qui occupe le centre, eſt un ovaire ſtérile, arrondi, comprimé, à cinq côtes. Il eſt couvert par les écailles qui ſont à la baſe des étamines.
Les fleurs femelles ont le calice ſemblable à celui des mâles.
La corolle eſt de même. Au lieu d'étamines, il y a dix écailles velues qui entourent l'ovaire.
Le piſtil eſt placé ſur un diſque charnu, arrondi ; il eſt compoſé de cinq ovaires ovoïdes, comme unis enſemble. Ils ſont ſurmontés chacun d'un style terminé par un stigmate obtus. Ces cinq ſtyles ſont comme réunis, & ont l’apparence en cet état d’un ſtyle à cinq cannelures, terminé par un stigmate à cinq rayons.
Les ovaires deviennent, en muriſſant, un fruit à cinq capſules ovoïdes, noirâtres, écartées les unes des autres, & portées ſur un corps charnu. Elles ſont marquées de la pointe à la baſe, ſur l’une & l’autre face, d'une petite arrête arrondie & ſaillante. La ſubſtance de l’écorce eſt peu ſucculente. La coque eſt mince & caſſante ; elle renferme une amande couverte d'une fine membrane blanchâtre.
Avant la maturité du fruit, les ovaires ſe ſéparent ; ils portent chacun un style.
On a repréſenté le fruit de grandeur naturelle. Les fleurs détachées ſont très groſſies. La Figure, planche 331, repréſente un jeune plan d'environ ſix mois, élevé a Paris au jardin du Roi, l'année 1767.
Les racines de cet arbre ſont fort groſſes, elles s'étendent au loin près la ſurface de la terre : on les trouvé ſouvent à moitié découvertes. Leur écorce eſt jaunâtre extérieurement, intérieurement blanchâtre, ainſi que leur partie ligneuſe. lorſqu'on entame l'écorce du tronc ou des racines, il en ſuinte un ſuc blanchâtre. On enlève l'écorce des racines ; on la fait fécher, on l'envoie enſuite en Europe pour, être vendue aux Droguiſtes. Dans le pays on s'en ſert en décoction pour guérir les fièvres & arrêter les dévoiements. Cette décoction eſt amère ; elle eſt purgative, & quelquefois vomitive. Cet uſage s'eſt communiqué en Europe, ou il a eu de grands succès dans les hôpitaux & les armées, pour la cure des dyſenteries & des longs dévoiements. Le bois de cet arbre a la même propriété, mais il eſt moins amer & moins actif que l'écorce. On le fait raper, & on le donne à la doſe de deux gros, bouilli dans une pinte d'eau, réduite à trois demi-ſetiers. Cette décoction réuſſit le plus ſouvent pour guérir le flux de ſang & les longues diarrhées, pour arrêter les pertes, & pour rétablir les digeſtions.
Cet arbre eſt nommé SIMAROUBA par les Galibis.
Le Quaſſia dont M. Linnaeus fait mention dans le ſixième Recueil de ſes Diſſertations, pag. 416, paroit avoir du rapport avec le genre du SIMAROUBA. Les uſages qu'on fait, du Quaſſia à Surinam, ſont les mêmes que ceux du Simarouba à Caïenne, parmi les Créoles, les Nègres & les Galibis.
Ces derniers font, avec une pierre tranchante de la nature de la lave, des entailles dans le bois de cet arbre coupé en planches, & ſe fervent de ces planches ainſi entaillées en façon & au lieu de rape, pour raper le manioc.
Cet arbre croît dans les lieux ſablonneux & humides, tant dans l'île de Caïenne que dans la Guiane, ou il n'eſt pas rare.
II étoit en fleur au mois de Novembre & de Décembre ; & en fruit en Mars & Avril. »
Simarouba amara a été décrit pour la première fois par Jean Baptiste Christophore Fusée Aublet en Guyane française en 1775 et est l'espèce type du genre Simarouba. En 1790, William Wright a décrit Quassia simarouba[16], qui, selon Auguste Pyrame de Candolle, était la même espèce que S. amara. Cependant, parce que S. amara a été décrit comme monoïque par Aublet et Q. simarouba a été décrit comme dioïque par Wright, ils étaient toujours considérés comme des espèces distinctes en 1829[17]. En 1874, lorsque la Flora Brasiliensis a été publiée, elles étaient considérées comme synonymes.[18]
Parmi les six espèces de Simarouba, deux autres que S. amara se trouvent sur le continent: S. glauca et S. versicolor. S. amara se distingue des autres espèces continentales par ses fleurs, anthères et fruits plus petits et ses pétales droits plutôt que courbes[3]. Les feuilles de Simarouba amara subsp. les opaca ne sont pas glauques (une couleur gris bleuâtre ou verte) sur leur face inférieure, alors que ceux de Simarouba amara subsp. typica sont.
Simarouba amara est connu sous de nombreux noms vernaculaires : En Bolivie, il est connu sous le nom de chiriuana, au Brésil sous le nom de marupa, marupuaba, parahyba, paraiba et tamanqueira. En Colombie, on l'appelle simaruba, en Équateur cedro amargo, cuna et guitarro, au Guyana simarupa, au Pérou marupa, au Suriname soemaroeba et au Venezuela cedro blanco et simarouba[19]. En Guyane, on l'appelle simarouba, acajou blanc (créole), ɨwë'ɨ (Wayãpi), tima aβain (Palikur), marupa, paraíba (Portugais), asumaipa (Paramaka, Ndjuka) ou simarupa (Kali'na)[20],[21].
L'aire naturelle de S. amara est dans les néotropiques, l'écorégion de l' Amérique centrale et du sud. Son aire de répartition s'étend du Guatemala au nord, à la Bolivie au sud et de l' Équateur à l'ouest, à la côte est du Brésil[3]. Il a été introduit dans les îles de la Dominique et de Porto Rico dans la mer des Caraïbes, devenant naturalisé à Porto Rico[22],[23]. Sur BCI, les arbres matures (> 10 cm dhp) se retrouvent à une fréquence de 5 par hectare, en Équateur à 0,7 par hectare et en Guyane à 0,4 par hectare. L'analyse génétique des populations suggère qu'il a toujours été relativement commun dans son aire de répartition[24]. Il pousse dans les forêts tropicales et dans les savanes[25]. Les plants de S. les amara sont rares dans la forêt primaire en raison de leur exigence en lumière[13].
Les populations de S. amara affichent des niveaux élevés d'hétérozygotie, ce qui indique qu'il est génétiquement diversifié. Cela est cohérent avec le croisement des arbres par un flux de pollen sur de longues distances, créant suffisamment de flux de gènes entre les populations pour contrer les effets de la dérive génétique. Une étude de 478 plantes de 14 populations à travers l'Amérique du Sud a révélé que 24% de tous les allèles se trouvaient dans une seule population[24]. Une étude de 300 plantes sur l'île de Barro Colorado a révélé que l'hétérozygosité à 5 locus microsatellites variait entre 0,12 et 0,75. 8 des 50 allèles marqués ont été trouvés dans une seule plante[5].
Les individus ne se reproduisent généralement pas avant d'avoir un diamètre de tronc de 30 cm. Une fois arrivés à maturité, les arbres produisent des fleurs chaque année, mais toutes les femelles ne produisent pas de fruits chaque année[5]. Leur morphologie florale est typique de la pollinisation de petits insectes généralistes tels que les abeilles et les papillons de nuit. Il a été rapporté qu'il était pollinisé par des papillons de nuit non sphingidés[26], mais d'autres auteurs se sont demandé si cela était correct[27].
Les graines de S. amara sont dispersés par des vertébrés, principalement des grands oiseaux et des mammifères, y compris les chachalacas, les moucherons, les motmots, les grives, les singes hurleurs, les tamarins[28] et les singes araignées. On a également observé que les fourmis coupeuses de feuilles dispersent les graines et que des tapis de semis denses se forment dans les zones où elles déversent des déchets[5] mais la plupart des semis meurent et la dispersion par les fourmis est considérée comme sans importance pour la dispersion[29]. Les graines qui sont mangées par les singes sont plus susceptibles de germer que les autres.[30] On a également noté que les chauves-souris phyllostomidés mangeuses de fruits dispersent leurs graines; cela peut aider à la régénération des forêts car elles dispersent les graines des espèces successives ultérieures alors qu'elles se nourrissent de S. amara[31] .
Sur la base de la modélisation inverse des données des pièges à graines sur BCI, la distance de dispersion moyenne estimée pour les graines est de 39 m[5]. L'étude des semis et des arbres parents sur BCI à l'aide de microsatellites d'ADN a révélé qu'en moyenne, les semis poussent àn392 m de leurs parents, avec un écart type de ± 234 m et une plage comprise entre 9 m et 1 km. Dans la forêt, il y a beaucoup de graines et de semis sous les femelles reproductrices; les données génétiques indiquent qu'il est peu probable que les semis proviennent d'adultes proches, mais qu'ils y soient plutôt dispersés par des vertébrés qui se sont nourris d'un arbre puis se sont déplacés pour se nourrir d'un autre, déféquant dans la canopée et déposant les graines[28].
Divers aspects de la physiologie ou S. amara ont été étudiés. La conductance stomatique des feuilles, une indication de la vitesse à laquelle l'eau s'évapore, des arbres matures à midi varie de 200 à 270 mmol H 2 O m −2 s −1 . Le potentiel hydrique des feuilles à midi varie de −0,56 à −1,85 M Pa, avec une moyenne d'environ −1,2 MPa. La cavitation est répandue dans le tronc et les stomates ne se ferment pas avant que la cavitation ne se produise. Bien que cela soit normalement considéré comme nocif pour l'arbre, cela peut amortir le potentiel hydrique des feuilles et donc être bénéfique. La conductance stomatique et la conductance hydraulique des branches d'arbres plus grands (~ 30 m) sont beaucoup plus hauts que dans les branches d'arbres plus petits (~ 20 m). Phillips, Bond et Ryan ont suggéré que cela était probablement dû aux branches d'arbres plus grands ayant un rapport feuille / aubier inférieur à celui des petites branches. La coloration des colorants montre que la cavitation est courante dans les branches de S. amara . Ils ont conclu que le flux d'eau dans S. amara est contrôlé par des moyens structurels (surface foliaire) plutôt que physiologiques (fermant les stomates)[11].
Les feuilles absorbent la lumière dans le spectre du rayonnement photosynthétiquement actif (PAR) à des longueurs d'onde comprises entre 400 nm et 700 nm avec un rendement élevé, mais le rendement diminue à des longueurs d'onde plus longues. En général, les usines absorbent le PAR à des rendements d'environ 85%; les valeurs plus élevées trouvées dans S. on pense que l' amara est due à la forte humidité de son habitat. La réflectance et la transmittance des feuilles sont faibles entre 400 et 700 nm. Les propriétés optiques et la masse des feuilles varient en fonction de leur emplacement dans le couvert forestier, les feuilles devenant plus épaisses et plus efficaces à mesure que leur hauteur dans la canopée augmente. Cependant, pour leur poids, les feuilles du sous-étage sont plus efficaces pour capter la lumière que les feuilles de la canopée[32].
La concentration de phosphate biodisponible s'est avérée plus élevée sous les individus femelles que sous les mâles, même si la concentration totale de phosphate est égale. Rhoades et coll. a conclu que cette différence était due au fait que les femelles modifiaient la disponibilité du phosphate, plutôt que les femelles ne grandissant que dans des zones à forte disponibilité de phosphate. On pense que cela est causé soit par les fruits contenant des niveaux élevés de phosphate qui tomberaient de l'arbre et pourriraient, soit par les fruits attirant les animaux qui déposent du phosphate sous les femelles. Il est également possible que les sexes produisent des exsudats racinaires différents, qui affectent la communauté microbienne de leur rhizosphère, affectant ainsi la disponibilité du phosphate[33].
Des expériences réalisées sur BCI où des tranchées ont été creusées autour de semis de S. amara, ou lorsque des trous dans la canopée ont été créés au-dessus d'eux, montrent que leur taux de croissance relatif peut être augmenté par les deux. Cela montre que leur croissance est normalement limitée à la fois par la compétition aérienne pour la lumière et par la compétition souterraine pour les nutriments et l'eau. La compétition pour la lumière est normalement plus importante, comme le montre le taux de croissance augmentant de près de 7 fois et la mortalité diminuant, lorsque les semis étaient placés dans des trous, par rapport au sous-étage. Lorsque les semis dans les interstices avaient une tranchée creusée autour d'eux pour empêcher la compétition souterraine, leur croissance augmentait encore, de 50%, ce qui démontre que dans les interstices, les plants sont limités par la compétition souterraine. Les tranchées autour des semis dans le sous-étage n'ont pas augmenté de manière significative leur croissance, montrant qu'ils ne sont normalement limités que par la concurrence pour la lumière[34].
Les plus gros plants ont plus de chances de survivre à la saison sèche sur BCI que les petits plants.[35] Une inhibition dépendante de la densité se produit entre les semis: ils sont plus susceptibles de survivre dans les zones où moins de semis de S. Amara grandit. Une étude sur des individus sur BCI a révélé que ce modèle peut être causé par des différences dans le biote du sol plutôt que par des insectes herbivores ou des champignons pathogènes. Les observations basées sur la distance entre les semis et leurs parents indiquent que l' hypothèse de Janzen-Connell s'applique aux semis de S. amara : ils sont plus susceptibles de survivre loin de leurs parents car ils échappent à des ravageurs tels que les herbivores et les agents pathogènes des plantes qui sont plus courants sous les arbres parents. [28]
Les jeunes arbres de S. Les amara sont exigeants en termes de lumière et se trouvent dans les zones plus lumineuses de la forêt tropicale par rapport aux plants de Pitheullobium elegans et de Lecythis ampla . Une étude à la station biologique de La Selva a révélé que les feuilles pèsent environ 30 g / m 2 (poids sec), similaire à P. elegans, mais environ le double du poids de L. ampla . La capacité photosynthétique des feuilles de S. amara est supérieur à celui des deux autres espèces, avec une moyenne d'environ 6 μmol m −1 s −1 . La respiration sombre est en moyenne de 0,72 μmol m -1 s -1, supérieure à celle des deux autres espèces. Le taux de photosynthèse maximal est en corrélation avec le diamètre de la tige et la croissance verticale. On pense que la lumière diffuse est plus importante pour la croissance des semis que les taches de soleil[13]. Une autre étude sur les jeunes arbres à La Selva a révélé qu'ils poussaient 7 cm an-1 en hauteur et 0,25 mm an-1 de diamètre. En moyenne, ils avaient neuf feuilles composées, un indice de surface foliaire de 0,54 et la surface totale de leurs feuilles était de 124 cm2. Les jeunes arbres qui avaient la plus faible surface foliaire étaient les plus susceptibles de mourir pendant l'étude et ceux qui avaient une plus grande surface foliaire poussaient plus vite que les autres jeunes arbres[14].
Une étude de jeunes arbres de un à quatre centimètres de diamètre sur BCI a révélé que la croissance des jeunes arbres ne variait pas selon les espèces qui poussaient à proximité, contrairement aux prévisions selon lesquelles une inhibition de la dépendance à la densité se produirait. Un modèle basé sur ces résultats a prédit que les jeunes arbres d'un diamètre de 2 cm sont capables de croître à un taux maximum de 13 mm an−1 et que si un autre arbre d'un diamètre de 10 cm grandit dans les 5 m du jeune arbre, sa croissance n'est réduite qu'à 12 mm an-1, indiquant qu'ils ne sont pas affectés par l'encombrement. Les arbres à plus de 15 m d'un jeune arbre n'affectent pas leur croissance[36].
Les lianes sont relativement rares sur les S. amara à maturité (> 20 cm dhp), par rapport à d'autres arbres sur BCI, avec seulement environ 25% ayant des lianes qui poussent dessus. Putz a suggéré que cela pourrait être dû aux grandes feuilles, mais le mécanisme par lequel cela réduirait le nombre de lianes est inconnu[10]. Les petits individus ont aussi moins de lianes et d'hémi-épiphytes que d'autres espèces d'arbres dans les mêmes forêts.[37]
On a signalé que le ver Atteva aurea et d'autres membres du genre Atteva mangeaient les nouvelles pointes de pousses de S. amara au Costa Rica[38]. Les larves de l'espèce de papillon, Bungalotis diophorus, se nourrissent exclusivement de jeunes arbres S. amara[39]. Deux espèces de termites ont été observées vivant sur S. amara au Panama, Calcaritermes brevicollis sur bois mort et Microcerotermes arboreus nichant dans une galerie sur une branche[40]. Des fourmis Paraponera clavata nichent à la base de S. amara[41]. L'Hemiptera, Enchophora sanguinea (Fulgoridae) a été trouvé préférentiellement sur les troncs de S. amara[42],[43].
Sensible aux insectes et aux champignons, le bois de Simarouba amara est utilisé pour le déroulage, les lambris, la sculpture, le bordage et la décoration[21], mais aussi localement pour la production de papier, de meubles, de contreplaqué et d'allumettes et est également utilisé dans la construction[5]. Il est également cultivé dans les plantations, car son bois clair et léger est très recherché sur les marchés européens pour la fabrication de meubles et de placages de qualité[6],[44]. Le bois sèche rapidement et est facile à travailler avec des outils normaux. Il est de couleur blanc crème à jaune clair, avec une texture grossière et un fil droit. Il doit être traité pour empêcher les champignons, les foreurs du bois et les termites de le manger. Le bois de cœur a une densité de 0,35–0,45 g/cm3[19]. Il a été noté comme l'une des meilleures essences de bois pouvant être cultivées en Amazonie péruvienne, avec Cedrelinga catenaeformis, en raison de ses caractéristiques de croissance rapide[45]. Le Fonds mondial pour la nature recommande aux consommateurs de s'assurer que le bois est certifié par le Forest Stewardship Council afin de ne pas contribuer à la déforestation[46].
Les copeaux de bois de Simarouba amara utilisés comme litière d'animaux, ont provoqué l'empoisonnement de chevaux et de chiens[47].
Les feuilles et l'écorce de S. amara ont été utilisées comme plante médicinale pour traiter la dysenterie, la diarrhée, le paludisme et d'autres maladies dans les régions où il se développe[réf. nécessaire]. En 1713, il a été exporté en France où il a été utilisé pour traiter la dysenterie pendant les épidémies entre 1718 et 1725. En 1918, son efficacité a été validée par une étude où des soldats dans un hôpital militaire ont reçu un thé à base d'écorce pour traiter la dysenterie amibienne. Dans une étude de 1944, l'Institut Merck a trouvé qu'il était efficace à 92% dans le traitement de l'amibiase intestinale chez les humains. Au cours des années 1990, les scientifiques ont démontré qu'il pouvait tuer la cause la plus courante de dysenterie, Entamoeba histolytica et les espèces de bactéries Salmonella et Shigella qui causent la diarrhée[48]. Une plus grande quantité de preuves[49] est nécessaire pour prouver l'efficacité de Simarouba.
Les principaux composés biologiquement actifs trouvés dans S. amara sont les quassinoïdes, un groupe de triterpènes comprenant l'ailanthinone, la glaucarubinone et l'holacanthone. Il a été rapporté que ceux-ci tuent les protozoaires, les amibes et le Plasmodium (la cause du paludisme). Les propriétés antipaludiques ont été étudiées pour la première fois par des scientifiques en 1947; ils ont trouvé que chez les poulets, 1 mg d'extrait d'écorce pour 1 kg de poids corporel avaient une forte activité antipaludique. En 1997, un brevet a été déposé aux États-Unis pour l'utilisation d'un extrait dans un produit de soin de la peau[48]. Simarouba amara ne doit pas être confondu avec Simarouba glauca, connu sous le nom de Lakshmi Taru en Inde.
En Guyane, les Créoles et les Palikur confectionnent un tonique amer réputé soigner la dysenterie et paludisme en macérant son écorce dans le rhum[20]. Il aurait aussi des propriétés fébrifuges, vermifuges, répulsives contre moustiques et poux d'agouti. Les Waikas de haute Amazonie en tirent une peinture corporelle noire[21].
Quassia simarouba (syn. S. amara) dessiné par Adolphus Ypey, 1813. Noter les fleurs mal colorées qui devraient être jaunes.
feuille de Simarouba amara (face supérieur luisante)
feuille de Simarouba amara (face inférieur claire)
folioles de Simarouba amara (face inférieur claire)
inflorescence de Simarouba amara
fleurs de Simarouba amara
fruits immatures de Simarouba amara
tronc immatures de Simarouba amara
écorce de Simarouba amara
houppier de Simarouba amara
houppier de Simarouba amara
rameau feuillé et fertile de Simarouba amara
Phrictus quinqueparitus (Fulgoridae) sur Simarouba amara) à la station biologique de La Selva (province de Heredia, Costa Rica).
Simarouba amara est une espèce d'arbre de la famille des Simaroubaceae, présente dans les forêts tropicales et les savanes d' Amérique du Sud et centrale et des Caraïbes. Il a été décrit pour la première fois par Aublet en Guyane française en 1775 et est l'une des six espèces de Simarouba. L'arbre est à feuilles persistantes, mais produit une nouvelle série de feuilles une fois par an. Il nécessite beaucoup de lumière pour se développer et se développe rapidement dans ces conditions, mais vit pendant une période relativement courte. Au Panama, il fleurit pendant la saison sèche en février et mars, tandis qu'au Costa Rica, où il n'y a pas de saison sèche, il fleurit plus tard, entre mars et juillet. Comme l'espèce est dioïque, les arbres sont mâles ou femelles et ne produisent que des fleurs mâles ou femelles. On pense que les petites fleurs jaunes sont pollinisées par des insectes, les fruits qui en résultent sont dispersés par des animaux, notamment des singes, des oiseaux et des chauves-souris frugivores, et les graines sont également dispersées par les fourmis coupeuses de feuilles .
Simarouba amara a été largement étudié par les scientifiques dans le but de comprendre l'arbre et également d'acquérir une meilleure compréhension de l'écologie de la forêt tropicale en général. Beaucoup de ces études ont été menées sur l'île de Barro Colorado (BCI) au Panama ou à la station biologique de La Selva au Costa Rica. Il est particulièrement intéressant de savoir comment il entre en compétition avec d'autres espèces et avec des individus de la même espèce à différents stades de son cycle de vie. Les semis sont normalement limités par la quantité de lumière et de nutriments trouvés là où ils poussent et les gaules sont considérées comme relativement exigeantes en lumière. Les jeunes individus ont plus de chances de survivre lorsqu'ils s'éloignent de leurs parents et lorsqu'il y a peu d'autres individus qui poussent près d'eux, ce qui peut être dû à leur capacité à échapper aux maladies. Les physiologistes des plantes ont étudié comment les feuilles de l'arbre diffèrent en fonction de leur emplacement dans la canopée forestière, trouvant qu'elles sont plus épaisses dans la canopée et plus minces dans le sous-bois. Ils ont également mesuré comment le potentiel hydrique de leurs feuilles change et quand leurs stomates s'ouvrent et se ferment pendant la journée; les résultats suggèrent que plutôt que de fermer leurs stomates pour contrôler la perte d'eau, elle est plutôt contrôlée par la surface foliaire. Les généticiens des populations ont examiné la manière dont ses gènes varient, à la fois à l'échelle locale et dans son aire de répartition, à l' aide de microsatellites. Il est génétiquement diversifié, ce qui indique que le flux génétique se produit entre les populations et que les graines peuvent être dispersées jusqu'à 1 km. Les feuilles de S. amara sont mangés par plusieurs espèces de chenilles, en particulier celles du genre Atteva . Plusieurs espèces de termites et de fourmis vivent sur ou autour de l'arbre et des lianes et des épiphytes poussent sur l'arbre.
L'écorce de S. amara a été utilisé pour traiter la dysenterie et la diarrhée, ainsi que d'autres maladies, et a également été exportée vers l'Europe au XVIIIe siècle pour traiter ces maladies. Un certain nombre de composés ont depuis été isolés de l'écorce et se sont avérés avoir des effets antimicrobiens. Les populations locales utilisent le bois de l'arbre à des fins diverses et il est également cultivé dans des plantations et récolté pour son bois, dont une partie est exportée.
Simarouba amara là một loài thực vật có hoa trong họ Thanh thất (Simaroubaceae), sống ở rừng nhiệt đới và xavan ở Nam, Trung Mỹ và Caribbe. Nó được mô tả lần đầu tiên bởi Aublet tại Guiana thuộc Pháp năm 1775 và là một trong sáu loài của chi Simarouba. Đây là cây thường xanh, nhưng thay lá một lần mỗi năm. Ở Panama, Nó nở hoa vào mùa khô vào khoảng tháng 2-3, ở Costa Rica, nơi không có mùa khô, nó nở hoa muộn hơn, vào giữa tháng 3-7. Chúng có cả hoa đực và hoa cái trên mỗi cây. Hoa nhỏ màu vàng thụ phấn nhờ côn trùng, quả được phát tán động vật (khỉ, chim, dơi quả).
Simarouba amara phát triển đến chiều cao 35 mét, đường kính thân tối đa 125 cm và tuổi thọ ước tính 121 years.[5][6][7] Nó có lá phức dài 60 cm, cuốn lá dài 4–7 cm và mỗi lá phức có 9–16 lá chét. Mỗi lá chét dài 2.5–11 cm và rộng 12–45 mm.[8] Hoa đơn tính, nhỏ (dài dưới 1 cm) và có màu vàng nhạt. Hoa được thụ phấn bởi côn trùng như ong và ngài. Trên đảo Barro Colorado (BCI), Panama, nó có xu hướng nở hoa vào mùa khô từ cuối tháng 1-4, kéo dài 11 tới 15 tuần mỗi năm.[5] Tại Costa Rica, nó nở hoa hơi muộn hơn từ giữa 3-7, đạt đỉnh vào tháng 4.[9] Kết quả 1-3 tháng sau khi thụ phấn. Quả màu từ xanh lục nhạt tới hơi đỏ tía-đen, dài chừng 17 mm và có hạt lớn (10–14 mm), chúng mọc thành nhóm 3–5 quả hạch. Hạt được phát phát tán bởi động vạt.[5] Mỗi hạt nặng khoảng 0.25 g.[6]
Phạm vi tự nhiên của S. amara là ở Neotropics, một vùng sinh thái Trung và Nam Mỹ. Mở rộng từ Guatemala ở phía bắc, tới Bolivia ở phía nam và từ Ecuador ở phía tây, tới bờ đông Brazil.[10] Nó đã được đưa đến các đảo của Dominica và Puerto Rico tại vùng biển Caribbe.[11][12] Ở BCI, cây trưởng thành (đường kính thân cây cao tới ngực trên 10 cm) được tìm thấy với mật độ 5/hécta, Ecuador là 0.7/hécta và Guiana thuộc Pháp là 0.4/hécta. S. amara luôn tương đối phổ biến trong phạm vi phân bố của nó.[13] Nó mọc trong rừng nhiệt đới và vùng xavan.[14] Trong rừng nguyên sinh có khá ít cây non do nhu cầu ánh sáng của cây non rất cao.[15]
|date= (trợ giúp)
Simarouba amara là một loài thực vật có hoa trong họ Thanh thất (Simaroubaceae), sống ở rừng nhiệt đới và xavan ở Nam, Trung Mỹ và Caribbe. Nó được mô tả lần đầu tiên bởi Aublet tại Guiana thuộc Pháp năm 1775 và là một trong sáu loài của chi Simarouba. Đây là cây thường xanh, nhưng thay lá một lần mỗi năm. Ở Panama, Nó nở hoa vào mùa khô vào khoảng tháng 2-3, ở Costa Rica, nơi không có mùa khô, nó nở hoa muộn hơn, vào giữa tháng 3-7. Chúng có cả hoa đực và hoa cái trên mỗi cây. Hoa nhỏ màu vàng thụ phấn nhờ côn trùng, quả được phát tán động vật (khỉ, chim, dơi quả).