mk
имиња во трошки


An infected triatomine assassin bug takes a blood meal and releases trypomastigotes (the characteristic infective developmental stage) in its feces near the site of the bite wound. Trypomastigotes enter the host through the wound or through intact mucosal membranes, such as the conjunctiva. Inside the host, the trypomastigotes invade cells near the site of inoculation, where they differentiate into intracellular amastigotes (a developmental stage without visible external flagella or cilia). The amastigotes multiply by binary fission and differentiate into trypomastigotes, which are then released into the circulation as bloodstream trypomastigotes. Trypomastigotes infect cells from a variety of tissues and transform into intracellular amastigotes in new infection sites. Clinical manifestations can result from this infective cycle. The bloodstream trypomastigotes do not replicate (in contrast to the trypanosomes that cause African Sleeping Sickness). Replication resumes only when the parasites enter another cell or are ingested by another vector. The triatomine bug becomes infected by feeding on human or animal blood that contains circulating parasites. The ingested trypomastigotes transform into epimastigotes in the vector’s midgut. The parasites multiply and differentiate in the midgut and differentiate into infective metacyclic trypomastigotes in the hindgut. Common triatomine vector species for trypanosomiasis belong to the genera Triatoma, Rhodnius, and Panstrongylus. Trypanosoma cruzi can also be transmitted through blood transfusions, organ transplantation, transplacentally, and in laboratory accidents. (Centers for Disease Control Parasites and Health website)
Trypanosoma cruzi occurs in the Americas from the southern United States to southern Argentina, mainly in poor, rural areas of Mexico, Central America, and South America. (Centers for Disease Control Parasites and Health website)
The protozoan parasite Trypanosoma cruzi causes Chagas disease in humans. Trypanosoma cruzi is transmitted to humans by blood-sucking triatomine assassin bugs (Reduviidae: Triatominae). The discovery of the cause of Chagas disease and the identification of the vector (as well as many important later related discoveries) is credited to the the pioneering Brazilian scientist Carlos Chagas. (Centers for Disease Control Parasites and Health website)
It has been estimated that there are 15 to 17 million people infected by T. cruzi in Latin America and 90 to 100 million are exposed to infection, although more optimistic estimates have been made more recently. Humans became important hosts of T. cruzi only during the past several centuries, as extensive deforestation for agriculture and livestock rearing led the triatomine vectors to colonize areas surrounding human dwellings and the dwellings themselves. (Coura and Borges-Pereira 2010 and references therein)In many Latin American countries, the associated burden from chronic Chagas disease is larger than the combined burden of malaria, leprosy, leishmaniasis, filariasis, schistosomiasis, dengue, and the major intestinal nematode infections (Abad-Franch et al. 2009 and references therein).
Much progress has been made against this disease in recent years. The genome of T. cruzi was published in 2005. In the last 10 to 15 years, T. cruzi transmission to people has been interrupted over vast areas of southern South America, with an estimated 73% reduction in incidence and sharp declines in burden figures (Abad-Franch et al. 2009 and references therein). Transmission of T. cruzi by the main vector, Triatoma infestans, was halted in in Uruguay in 1997, in Chile in 1999, in Brazil in 2006, and in Guatemala in 2009. Incidence of Chagas disease has dropped from 700,000 new cases per year to 40,000, and the annual number of deaths has fallen from more than 45,000 to 12,500. However, the epidemiology of the disease has become more complex because of multiple vectors and reservoirs and the added effects of geopolitical, economic, and ecological upheavals. In contrast to South America, the pattern of change in Central America is quite homogeneous, with substantial advances in elimination of the main vector there (Rhodnius prolixus). Because of migration patterns, the United States, Canada, Europe, Australia, and Japan are most at risk for imported Chagas disease (the estimated number of cases of T. cruzi infection imported into the U.S.A. in 2006 was between 30,000 and 300,000). In the U.S.A., several southern states have host vectors and reservoirs for T. cruzi, but native cases in humans there remain very rare. (Lescure et al. 2010 and references therein)
Trypanosoma cruzi és un protist de la classe Kinetoplastea, família Trypanosomatidae, caracteritzat per la presència d'un sol flagel i una sola mitocondri, dins de la qual el seu genoma es troba ordenat en una complexa i compacta xarxa anomenada cinetoplast. És un paràsit intracel·lular amb un cicle de vida que involucra vertebrats i invertebrats. És l'agent etiològic de la malaltia de Chagas.
Produeix l'anomenada malaltia de Chagas a Amèrica. La disseminació del T. cruzi es dóna pel contacte amb els excrements d'insectes del tipus hemípters (xip) entrant els paràsits per la ferida causada per la seva picada; arriben al del torrent sanguini (forma tripomastigota metacíclics) viatja cap als diferents òrgans i teixits, replicant principalment en teixits musculars i nerviós (forma amastigota). Poden produir cardiopatia chagàsica danys irreparables en els plexes mientèric del tracte gastrointestinal, fent que la persona present megaesòfag, megacòlon i que eventualment mori, a més de tot això la persona pot no presentar símptomes el que beneficia el paràsit, ja que a través del temps sigui més patogen.
Trypanosoma cruzi és un protist de la classe Kinetoplastea, família Trypanosomatidae, caracteritzat per la presència d'un sol flagel i una sola mitocondri, dins de la qual el seu genoma es troba ordenat en una complexa i compacta xarxa anomenada cinetoplast. És un paràsit intracel·lular amb un cicle de vida que involucra vertebrats i invertebrats. És l'agent etiològic de la malaltia de Chagas.
Trypanosoma cruzi (někdy trypanozoma americká nebo trypanozoma Chagasova[1]) je parazitický prvok z rodu Trypanosoma, původce Chagasovy choroby čili americké trypanozomiázy. Řadí se do skupiny trypanozom Stercoraria, které dokončují svůj vývoj v zadní část trávicí soustavy přenašečů (v tomto případě ploštic).[2]
Druh Trypanosoma cruzi je velice hostitelsky nespecifický, což znamená, že napadá široké spektrum divokých i domácích zvířat. Vyskytuje se v Jižní Americe (na jih až v Argentině) a v Severní Americe (na sever až do Texasu). Přenašeči těchto prvoků jsou ploštice zákeřnice (podčeleď Triatominae). Z výkalů těchto krevsajících ploštic se zanáší do ran trypomastigoti a v buňkách tohoto dalšího hostitele (např. člověka) se začnou množit jako tzv. amastigoti.[2] Toto stadium přebývá v nejrůznějších orgánech, jako je srdce, mozek či játra.[3] Postupně se trypanozomy uvolňují do krve, odkud mohou být jako trypomastigoti nasáti plošticí. Vyvíjí se v střevě zákeřnice (jako epimastigoti a posléze trypomastigoti) a s výkaly odcházejí ven, čímž se kruh uzavírá.[2]
Od T. brucei se její životní cyklus liší existencí drobného amastigota žijícího uvnitř tělních buněk obratlovčího hostitele.[3]
Trypanosoma cruzi (někdy trypanozoma americká nebo trypanozoma Chagasova) je parazitický prvok z rodu Trypanosoma, původce Chagasovy choroby čili americké trypanozomiázy. Řadí se do skupiny trypanozom Stercoraria, které dokončují svůj vývoj v zadní část trávicí soustavy přenašečů (v tomto případě ploštic).
Trypanosoma cruzi ist ein einzelliger Parasit, der als Erreger der Chagas-Krankheit (Amerikanische Trypanosomiasis) in Lateinamerika große medizinische Bedeutung hat. In Endemiegebieten zirkuliert der Parasit zwischen blutsaugenden Raubwanzen und einer Vielzahl von Säugetierarten einschließlich Haustieren.
Trypanosoma cruzi wurde erstmals 1909 vom brasilianischen Arzt Carlos Chagas beschrieben und nach dem Arzt Oswaldo Cruz benannt.[1][2] Der Einzeller hat eine einzelne Geißel sowie einen großen Kinetoplasten. Der Parasit kommt in mehreren Formen vor, die sich morphologisch unterscheiden:
Der für die Arten der Kinetoplastea charakteristische Kinetoplast ist eine Ansammlung von DNA innerhalb eines großen Mitochondriums.
Es werden aufgrund biochemischer Unterschiede zwei Subtypen von T. cruzi unterschieden, der relativ homogene Typ I sowie der Typ II, der nach molekulargenetischen Analysen weiter in IIa-e unterteilt wurde.[3] Die Typen, die derzeit keinen taxonomischen Rang haben, unterscheiden sich nicht nur molekular, sondern unter anderem auch in der typischen Wirtsart. Die Bezeichnung Trypanosoma cruzi cruzi als Unterart für alle humanpathogenen Isolate ist nicht mehr gebräuchlich. Die Unterart Trypanosoma cruzi marinkellei wurde aus südamerikanischen Fledermäusen isoliert.
Trypanosoma cruzi ist in Süd- und Mittelamerika von Mexiko bis zum südlichen Argentinien verbreitet, insbesondere arme, ländliche Gebiete sind betroffen.[4] Infizierte Tiere werden aber auch in den USA gefunden.
Bei den Insekten sind Raubwanzen der Unterfamilie Triatominae Zwischenwirte, insbesondere Arten der Gattungen Rhodnius und Triatoma. Der wichtigste Vektor bei der Infektion von Menschen ist Triatoma infestans. Unter den Säugetieren sind unter anderem Haustiere wie Hund und Katze, aber auch hausnah lebende Nagetiere wichtige Wirte, während unter den Wildtieren Opossums (für T. cruzi Typ I) und Gürteltiere (für T. cruzi Typ II) die wichtigsten Reservoirs sind.[5]
Im Darm der Raubwanzen wandelt sich der bei einer Blutmahlzeit aufgenommene Parasit von einem Trypomastigot zu einem Epimastigot um; diese können sich im Verdauungstrakt der Wanze durch Teilung vermehren. Im Enddarm der Wanzen entstehen aus den Epimastigoten wiederum neue Trypomastigote, die mit dem Kot ausgeschieden werden und Säugetierwirte durch Hautverletzungen oder Schleimhäute infizieren können.
In Säugetieren kommen die Parasiten als Trypomastigote im Blutstrom oder als Amastigote im inneren von Körperzellen vor. Nach der Infektion sind meist Makrophagen in der Haut das erste Ziel.[6] Die intrazellulären Amastigoten können sich im Zytoplasma der Wirtszelle durch Teilung vermehren und nach erneuter Umwandlung in Trypomastigote die Wirtszelle zerstören. Damit gelangen sie wieder in die Blutbahn und können weitere Körperzellen des Wirbeltierwirtes, unter anderem Herzmuskelzellen, oder eine neue blutsaugende Raubwanze infizieren.
Von Mensch zu Mensch ist auch eine Übertragung von Trypomastigoten durch Bluttransfusionen und Organtransplantationen sowie durch die Plazenta von der Mutter auf den Fötus möglich.
Die vollständige Genom-DNA-Sequenz von Trypanosoma cruzi wurde im Jahr 2005 publiziert; das 60 Megabasenpaare große Genom ist hoch repetitiv und enthält zirka 12.000 verschiedene Gene.[7] Der Parasit hat an der Zelloberfläche eine Glykokalyx mit einer komplexen Auswahl von Oberflächenantigenen, darunter viele Glykokonjugate. Dementsprechend sind im Genom trans-Sialidasen besonders stark vertreten, ebenso wie andere für die Zelloberfläche wichtige Genfamilien wie Muzine und Muzin-assoziierte Oberflächenproteine; all diese Genfamilien sind mit jeweils mehreren hundert Genen vertreten.[7] Sie spielen offensichtlich eine wichtige Rolle beim Umgehen des Immunsystems des Säugetierwirtes.
Es gibt nur zwei Arzneistoffe, die in Arzneimitteln gegen die Chagas-Krankheit eingesetzt werden, Nifurtimox und Benznidazol. Beide wirken über die Bildung freier Radikale bei der Metabolisierung; diese kann der Parasit schlecht abbauen, da ihm entsprechende Enzyme fehlen oder sie nur niedrige Aktivität haben. Es gibt aber durch die Genomsequenz inzwischen eine ganze Reihe von neuen Targets, die für die Entwicklung neuer Arzneimittel in Frage kommen.[8]
Behandlungsbedürftige Infektionen mit Trypanosoma cruzi werden nach Rücksprache mit einem therapieerfahrenen Zentrum mit Benznidazol oder Nifurtimox therapiert.[9]
Trypanosoma cruzi ist ein einzelliger Parasit, der als Erreger der Chagas-Krankheit (Amerikanische Trypanosomiasis) in Lateinamerika große medizinische Bedeutung hat. In Endemiegebieten zirkuliert der Parasit zwischen blutsaugenden Raubwanzen und einer Vielzahl von Säugetierarten einschließlich Haustieren.
Lo Trypanosoma cruzi es un protozoari responsable de la Malautiá de Chagas, una malautiá originària d'America qu'afècta lo sistèma nerviós central dels animals e tanben dels umans, e pòt tuar per crisi cardiaca. Lo trypanosoma e tanben son vector (l'insècte Triatoma infestans) foguèron descobèrts per lo mètge brasilièr Carlos Chagas.
Trypanosoma cruzi is a species of parasitic euglenoids. Among the protozoa, the trypanosomes characteristically bore tissue in another organism and feed on blood (primarily) and also lymph. This behaviour causes disease or the likelihood of disease that varies with the organism: Chagas disease in humans, dourine and surra in horses, and a brucellosis-like disease in cattle. Parasites need a host body and the haematophagous insect triatomine (descriptions "assassin bug", "cone-nose bug", and "kissing bug") is the major vector in accord with a mechanism of infection. The triatomine likes the nests of vertebrate animals for shelter, where it bites and sucks blood for food. Individual triatomines infected with protozoa from other contact with animals transmit trypanosomes when the triatomine deposits its faeces on the host's skin surface and then bites. Penetration of the infected faeces is further facilitated by the scratching of the bite area by the human or animal host.
The Trypanosoma cruzi life cycle starts in an animal reservoir, usually mammals, wild or domestic, including humans. A triatomine bug serves as the vector. While taking a blood meal, it ingests T. cruzi. In the triatomine bug (Triatoma infestans) the parasite goes into the epimastigote stage, making it possible to reproduce. After reproducing through binary fission, the epimastigotes move onto the rectal cell wall, where they become infectious. Infectious T. cruzi are called metacyclic trypomastigotes. When the triatomine bug subsequently takes a blood meal from a host, it defecates—its waste containing T. cruzi propagation stages. This is the parasite's only transmission route. As a result Trumper and Gorla 1991 find transmission success centers around the triatomine's defecation behaviors.[4][5][6] The trypomastigotes are in the feces and are capable of swimming into the host's cells using flagella, a characteristic swimming tail dominant in the Euglenoid class of protists.[7]
The trypomastigotes enter the host through the bite wound or by crossing mucous membranes. The host cells contain macromolecules such as laminin, thrombospondin, heparin sulphate, and fibronectin that cover their surface.[8] These macromolecules are essential for adhesion between parasite and host and for the process of host invasion by the parasite. The trypomastigotes must cross a network of proteins that line the exterior of the host cells in order to make contact and invade the host cells. The molecules and proteins on the cytoskeleton of the cell also bind to the surface of the parasite and initiate host invasion.[8]
Trypanosomiasis in humans progresses with the development of the trypanosome into a trypomastigote in the blood and into an amastigote in tissues. As the infection progresses, the number of infected cells increases, as well as the number of amastigotes per infected cell (APC). If the average of APC is one or close to one, the infection has just begun. A higher APC means that amastigotes have started to replicate. [9]
The acute form of trypanosomiasis is usually unnoticed, although it may manifest itself as a localized swelling at the site of entry. In this form appears elevated parasitism, myocarditis, and changes in the myocardial gene expression. The chronic form may develop 30 to 40 years after infection and affect internal organs (e.g., the heart, the oesophagus, the colon, and the peripheral nervous system). Affected people may die from heart failure and severe heart lesions.[10]
Acute cases are treated with nifurtimox and benznidazole, but no effective therapy for chronic cases is currently known.
Researchers of Chagas’ disease have demonstrated several processes that occur with all cardiomyopathies. The first event is an inflammatory response. Following inflammation, cellular damage occurs. Finally, in the body's attempt to recover from the cellular damage, fibrosis begins in the cardiac tissue.[11]
Another cardiomyopathy found in nearly all cases of chronic Chagas’ disease is thromboembolic syndrome. Thromboembolism describes thrombosis, the formation of a clot, and its main complication is embolism, the carrying of a clot to a distal section of a vessel and causing blockage there. This occurrence contributes to the death of a patient by four means: arrhythmias, stasis secondary to cardiac dilation, mural endocarditis, and cardiac fibrosis. These thrombi also affect other organs such as the brain, spleen and kidney.[12]
Subcellular findings in murine studies with induced T. cruzi infection revealed that the chronic state is associated with the persistent elevation of phosphorylated (activated) extracellular-signal-regulated kinase (ERK), AP-1, and NF-κB. Also, the mitotic regulator for G1 progression, cyclin D1 was found to be activated. Although there was no increase in any isoform of ERK, there was an increased concentration of phosphorylated ERK in mice infected with T. cruzi. It was found that within seven days the concentration of AP-1 was significantly higher in T. cruzi–infected mice when compared to the control. Elevated levels of NF-κB have also been found in myocardial tissue, with the highest concentrations being found in the vasculature. It was indicated through Western blot that cyclin D1 was upregulated from day 1 to day 60 post-infection. It was also indicated through immunohistochemical analysis that the areas that produced the most cyclin D1 were the vasculature and interstitial regions of the heart.[13]
Conduction abnormalities are also associated with T. cruzi. At the base of these conduction abnormalities is a depopulation of parasympathetic neuronal endings on the heart. Without proper parasympathetic innervations, one could expect to find not only chronotropic but also inotropic abnormalities. It is true that all inflammatory and non-inflammatory heart disease may display forms of parasympathetic denervation; this denervation presents in a descriptive fashion in Chagas’ disease. It has also been indicated that the loss of parasympathetic innervations can lead to sudden death due to a severe cardiac failure that occurs during the acute stage of infection.[14]
Another conduction abnormality presented with chronic Chagas’ disease is a change in ventricular repolarization, which is represented on an electrocardiogram as the T-wave. This change in repolarization inhibits the heart from relaxing and properly entering diastole. Changes in the ventricular repolarization in Chagas’ disease are likely due to myocardial ischemia. This ischemia can also lead to fibrillation. This sign is usually observed in chronic Chagas’ disease and is considered a minor electromyocardiopathy.[15]
Villous plaque is characterized by exophytic epicardial thickening, meaning that the growth occurs at the border of the epicardium and not the center of mass. Unlike milk spots and chagasic rosary, inflammatory cells and vasculature are present in villous plaque. Since villous plaque contains inflammatory cells it is reasonable to suspect that these lesions are more recently formed than milk spots or chagasic rosary.[16]
When mammalian cells are present, trypomastigotes move in a sub diffusive fashion in short periods of time, but under control conditions their motion is diffusive.
Parasites increase their mean speed; they explore smaller areas at short time scales and show a preference to be located nearby cells’ periphery. The extent of these changes depends on the cell type. Therefore, T. cruzi trypomastigotes can sense mammalian cells and modify their motility patterns to prepare themselves for infection.[9]
Epimastigotes, which are the culture forms of T. cruzi, swim in the direction of their flagellum, due to tip-to-base symmetrical flagellar beats, that are interrupted by base-to-tip highly asymmetric beats. Switching between both beating modes facilitates parasite reorientation, allowing many movements and trajectories. Epimastigote motility is characterized by alternation of quasi-rectilinear and restricted and complex paths. [9]
The invasion efficiency is positively correlated with the average parasite mean speed, and negatively correlated with the mean square displacement (MSD). Therefore, the motility modifications undergone by the parasites in the presence of mammalian cells may be functionally related to the cell invasion process.
Moreover, different parasite strains infect different tissues with a variable invasion efficiency, due to the high genetic and phenotypic variability found among T. cruzi strains. T. cruzi trypomastigotes are capable of sensing mammalian cells to a different degree, depending on the cell type, and can modify their motility patterns to increase their invasion efficiency. [9]
T. cruzi does not produce prostaglandins itself. Instead Pinge-Filho et al 1999 finds that the parasite induces mice to overproduce 2-series prostaglandins themselves.[17] These PG2s are immunosuppressive and so aid in immune evasion.[17]
Imipramines are trypanocidal.[17] Doyle & Weinbach 1989 find imipramine and various of its derivatives – 3-Chlorimipramine, 2-Nitroimipramine, and 2-Nitrodesmethylimipramine – are trypanocidal in vitro.[17] They find 2-Nitrodesmethylimipramine is the most effective among them.[17]
T. cruzi transmission has been documented in the Southwestern U.S., and warming trends may allow vector species to move north. U.S. domestic and wild animals are reservoirs for T. cruzi. Triatomine species in the southern U.S. have taken human blood meals, but because triatomines do not favor typical U.S. housing, risk to the U.S. population is very low.[18]
Chagas' disease's geographical occurrence happens worldwide but high-risk individuals include those who don't have access to proper housing. Its reservoir is in wild animals but its vector is a kissing bug. This is a contagious disease and can be transmitted through a number of ways: congenital transmission, blood transfusion, organ transplantation, consumption of uncooked food that has been contaminated with feces from infected bugs, and accidental laboratory exposure.
Over 130 species can transmit this parasite[19]
Six taxonomic subunits are recognised.[20]
The incubation period is five to fourteen days after a host comes in contact with feces. Chagas disease undergoes two phases, which are the acute and the chronic phase. The acute phase can last from two weeks to two months but can go unnoticed because symptoms are minor and short-lived. Symptoms of the acute phase include swelling, fever, fatigue, and diarrhea. The chronic phase causes digestive problems, constipation, heart failure, and pain in the abdomen.
Diagnostic methods include microscopic examination, serology, or the isolation of the parasite by inoculating blood into a guinea pig, mouse, or rat.
No vaccines are available. The most used method for epidemiological management and disease prevention resides within vector control,[21] mainly by the use of insecticides and taking preventative measures such as applying bug repellent on the skin, wearing protective clothing, and staying in higher quality hotels when traveling. Investing in quality housing would be ideal to decrease risk of contracting this disease.[22]
Genetic exchange has been identified among field populations of T. cruzi.[23] This process appears to involve genetic recombination as well as a meiotic mechanism. Despite the capability for sexual reproduction, natural populations of T. cruzi exhibit clonal population structures. It appears that frequent sexual reproduction events occur primarily between close relatives resulting in an apparent clonal population structure.[24]
Trypanosoma cruzi is a species of parasitic euglenoids. Among the protozoa, the trypanosomes characteristically bore tissue in another organism and feed on blood (primarily) and also lymph. This behaviour causes disease or the likelihood of disease that varies with the organism: Chagas disease in humans, dourine and surra in horses, and a brucellosis-like disease in cattle. Parasites need a host body and the haematophagous insect triatomine (descriptions "assassin bug", "cone-nose bug", and "kissing bug") is the major vector in accord with a mechanism of infection. The triatomine likes the nests of vertebrate animals for shelter, where it bites and sucks blood for food. Individual triatomines infected with protozoa from other contact with animals transmit trypanosomes when the triatomine deposits its faeces on the host's skin surface and then bites. Penetration of the infected faeces is further facilitated by the scratching of the bite area by the human or animal host.
Trypanosoma cruzi es un protista de la clase Kinetoplastea, familia Trypanosomatidae, caracterizado por la presencia de un solo flagelo y una sola mitocondria, cuyo genoma se encuentra ordenado en una compleja y compacta región dentro de la propia mitocondria, y cerca de la base del flagelo denominada cinetoplasto. Es un parásito intracelular con un ciclo de vida que involucra vertebrados e invertebrados. Es el agente etiológico de la enfermedad de Chagas.
La enfermedad de Chagas es una de las más importantes enfermedades por vector. En México, se conocen 31 especies de vectores triatominos. 18 de ellos son naturalmente infectados con Trypanosoma cruzi, el agente de la enfermedad de Chagas (Lent and Wygodzinsky, 1979; Carcavallo et al., 1997). La mayoría de las especies son encontradas en viviendas y áreas peridomésticas humanos principalmente selváticas. (Zarate and Zárate, 1985; Velasco-Castrejón and Guzman-Bracho, 1986), por esto será necesario desarrollar estrategias de control apropiadas a las condiciones entomológicas locales.[1]
Presenta cuatro formas distintas de involución: amastigota, promastigota, epimastigota y tripomastigota.
Subfamilia Triatominae:
Existe una subespecie en Sudamérica la cual infecta murciélagos, es identificada como Trypanosoma cruzi marinkellei[4]
T. cruzi se divide en dos grandes grupos: T. cruzi I y T. cruzi II. Este último a su vez se divide en cinco grupos menores: T. cruzi IIa, IIb, IIc, IId y IIe. T. cruzi II está mucho más asociado a los casos crónicos de la enfermedad de chagas, al menos en el cono sur de Sudamérica.[5]
Produce la llamada enfermedad de Chagas en América. La diseminación del T. cruzi se da por el contacto con las heces de insectos del tipo hemípteros, del género Triatoma, entrando los parásitos por la herida causada por su picadura; llegan al torrente sanguíneo (forma tripomastigota metacíclico) viajando hacia los diferentes órganos y tejidos, replicándose principalmente en tejidos musculares y nervioso (forma amastigota). Pueden producir cardiopatía chagásica daños irreparables en los plexos mientéricos del tracto gastrointestinal, haciendo que la persona presente megaesófago, megacolon y que eventualmente muera, además de todo esto la persona puede no presentar síntomas lo que beneficia al parásito ya que a través del tiempo sea más patógeno.
Se presupone que el daño principal ocasionado en la enfermedad de Chagas se debe a la lesión directa que produce el parásito al invadir a las células del ser vivo, y también al consiguiente proceso inflamatorio localizado. El proceso de invasión celular, replicación y muerte de las células, con la consecuente liberación de los parásitos y reinfección de otras células, provoca daños irreversibles en los órganos afectados, sobre todo en corazón y órganos del sistema digestivo (esófago y colon en particular). Con el paso de los años, la extensión de las zonas afectadas, además del compromiso de células del sistema nervioso periférico que inervan estos órganos, produce las alteraciones que se observan en la fase crónica de la enfermedad.[6]
Algunas proteínas del parásito poseen epítopos compartidos con proteínas del huésped. Se han descrito anticuerpos circulantes en pacientes con enfermedad de Chagas crónica que reaccionan contra proteínas de tejido conjuntivo, endocardio, laminina y proteínas de músculo estriado, entre otras. Se ha sugerido que estos autoanticuerpos son los causantes del proceso crónico de la afección en virtud del reconocimiento de partículas proteicas propias o extrañas, y activación de un proceso inmunológico humoral y celular en contra de los órganos del huésped. Cuando muere el parásito también es posible que sus componentes se depositen en la superficie de las células del huésped, siendo las más afectadas las del sistema nervioso. De esta manera, los componentes de la respuesta inmune reaccionan contra estos antígenos y, por consiguiente, contra el huésped.[6]
Esta teoría asume que el daño del parásito se observa principalmente en las células del sistema parasimpático que inerva los órganos afectados. El daño tiene como consecuencia una estimulación simpática excesiva, que a través de los años causa una lesión irreversible por sobrecarga de trabajo. En esta teoría se considera el daño directo como un factor relevante de la fisiopatológica de la enfermedad, pero reduce la importancia del proceso sólo a las células del sistema nervioso periférico, estas son denominadas células procariotas.
Una vez que el parásito logra infestar al huésped, mediante el empleo de posaconazol, el cual inhibe la síntesis de ergosterol y en consecuencia limita la sobrevida de este parásito, se puede controlar la parasitosis, más aún al combinarlo con amiodarona.
En otros países se siguen utilizando los medicamentos benzinidazol y nifurtimox.[6]
Trypanosoma cruzi es un protista de la clase Kinetoplastea, familia Trypanosomatidae, caracterizado por la presencia de un solo flagelo y una sola mitocondria, cuyo genoma se encuentra ordenado en una compleja y compacta región dentro de la propia mitocondria, y cerca de la base del flagelo denominada cinetoplasto. Es un parásito intracelular con un ciclo de vida que involucra vertebrados e invertebrados. Es el agente etiológico de la enfermedad de Chagas.
La enfermedad de Chagas es una de las más importantes enfermedades por vector. En México, se conocen 31 especies de vectores triatominos. 18 de ellos son naturalmente infectados con Trypanosoma cruzi, el agente de la enfermedad de Chagas (Lent and Wygodzinsky, 1979; Carcavallo et al., 1997). La mayoría de las especies son encontradas en viviendas y áreas peridomésticas humanos principalmente selváticas. (Zarate and Zárate, 1985; Velasco-Castrejón and Guzman-Bracho, 1986), por esto será necesario desarrollar estrategias de control apropiadas a las condiciones entomológicas locales.
Trypanosoma cruzi Euglenozoaren barruko Trypanosoma generoko izakia da. Espezie honek Chagasen gaixotasuna sortzen du gizakiengan eta beste animalia batzuengan Amerikan.
Trypanosoma cruzi, ou Schizotrypanum cruzi, est une espèce de parasites de l'ordre des Trypanosomatida. L'espèce provoque des maladies, des trypanosomiases chez l'homme et les animaux en Amérique du Sud. L'espèce est transmise par les fèces de réduves (punaises des genres Triatoma, Rhodnius ou Panstrongylus).
Le parasite est absorbé par le réduve lorsqu'il pique une victime, humaine ou animale, contaminée par Trypanosoma cruzi sous sa forme trypomastigote, circulant dans le sang. Une fois dans l'estomac de l'animal, T.cruzi se développe et se multiplie sous sa forme épimastigote. Il est ensuite retrouvé dans l'intestin du réduve sous sa forme trypomastigote métacyclique (forme proche de la forme circulante infectant l'homme). On retrouve cette dernière forme dans les fèces du réduve. Un réduve infecté par T.cruzi reste contaminant toute sa vie.
Il faut environ 3 semaines entre la piqûre infectant l'animal et l'émission des premiers parasites dans les fèces.
Contrairement au cas des trypanosomes africains, T. cruzi n'est pas injecté par le proboscis de l'insecte. Lorsque le réduve pique, il émet en même temps des fèces, contenant le parasite. L'insecte pique souvent près de muqueuses (du visage, notamment les yeux), et la victime se contamine en grattant l'endroit de la piqûre, mettant en contact la plaie due à la piqûre de l'insecte et les fèces infectées.
À l'intérieur de l'hôte, les formes trypomastigotes envahissent les cellules, dans lesquelles elle se différencient dans des formes amastigotes intracellulaires. Les amastigotes se multiplient par fission binaire et se différencient en trypomastigotes, puis sont relâchés dans la circulation sanguine.
Les trypomastigotes infectent les cellules de divers tissus et se retransforment en amastigotes intracellulaires dans les nouveaux sites d'infection. Les signes cliniques peuvent résulter de ce cycle infectieux.
Les formes trypomastigotes circulantes ne se répliquent pas (différence avec les trypanosomes Africains). Il y a réplication uniquement lorsque le parasite entre dans une autre cellule ou est ingérée par un nouveau réduve.
Trypanosoma cruzi peut aussi être transmis pendant les transfusions sanguines, les transplantations d'organes ou de la mère au fœtus à travers le placenta.
La trypanosomiase humaine américaine, ou maladie de Chagas, est une maladie potentiellement fatale.
La première phase de la maladie, la phase aiguë est généralement asymptomatique et ne se constate que par la présence d'un gonflement localisé au niveau du site d'entrée du parasite dans la peau.
La phase chronique se déclare généralement 10 à 20 ans après l'infection. Cette phase affecte les organes internes du système cardiaque et digestif (cœur, œsophage, côlon, système nerveux périphérique). Les personnes infectés meurent généralement d'insuffisance cardiaque.
Les thérapies actuelles consistent en des cures de Nifurtimox (autorisé seulement en Allemagne et en Argentine) et benznidazole (vendu par Hoffman-La Roche sous les dénominations commerciales Rochagan et Radanil) pour la phase aiguë asymptomatique. Il n'y a pas de thérapies efficaces pour la phase chronique.
Trypanosoma cruzi, ou Schizotrypanum cruzi, est une espèce de parasites de l'ordre des Trypanosomatida. L'espèce provoque des maladies, des trypanosomiases chez l'homme et les animaux en Amérique du Sud. L'espèce est transmise par les fèces de réduves (punaises des genres Triatoma, Rhodnius ou Panstrongylus).
Trypanosoma cruzi é unha especie de protozoo parasito euglenozoo que causa tripanosomíases en humanos e animais en América, como a enfermidade de Chagas humana. A transmisión realízana insectos hemípteros triatominae cando depositan as súas feces na superficie da pel dos seus hóspedes e despois pican. Cando o hóspede humano ou animal se raña na zona irritada pola picadura, a penetración na ferida de feces co parasito vese facilitada.
A tripanosomíase humana americana ou enfermidade de Chagas ten dúas formas, a forma aguda xeralmente pasa desapercibida e pode manifestarse como un inchamento localizado no sitio de entrada; a forma crónica pode presentarse 10 ou 20 anos despois da infección e afectar a órganos internos, como o corazón, esófago, colon, e o sistema nervioso periférico). As persoas afectadas poden morrer de insuficiencia cardíaca. O parasito pode estar en forma de tripomastigota no sangue humano ou de amastigota nos tecidos e de epimastigota nos insectos.
Os casos agudos trátanse con nifurtimox e benznidazole, pero non hai actualmente ningunha terapia efectiva contra os casos crónicos.
O T. cruzi pode presentar tres formas distintas: amastigota, epimastigota e tripomastigota.
O ciclo de vida de T. cruzi empeza nun animal que serve de reservorio, xeralmente un mamífero salvaxe ou doméstico ou un ser humano. Un insecto Triatominae serve como vector.
T. cruzi divídese en dous grandes grupos: T. cruzi I e T. cruzi II. Este último á súa vez divídese en cinco grupos menores: T. cruzi IIa, IIb, IIc, IId e IIe. T. cruzi II está moito máis asociado aos casos crónicos da enfermidade de Chagas, polo menos no cono sur de Suramérica.[4]
Trypanosoma cruzi pode ser cultivado doadamente co medio NNN.
Trypanosoma cruzi é unha especie de protozoo parasito euglenozoo que causa tripanosomíases en humanos e animais en América, como a enfermidade de Chagas humana. A transmisión realízana insectos hemípteros triatominae cando depositan as súas feces na superficie da pel dos seus hóspedes e despois pican. Cando o hóspede humano ou animal se raña na zona irritada pola picadura, a penetración na ferida de feces co parasito vese facilitada.
A tripanosomíase humana americana ou enfermidade de Chagas ten dúas formas, a forma aguda xeralmente pasa desapercibida e pode manifestarse como un inchamento localizado no sitio de entrada; a forma crónica pode presentarse 10 ou 20 anos despois da infección e afectar a órganos internos, como o corazón, esófago, colon, e o sistema nervioso periférico). As persoas afectadas poden morrer de insuficiencia cardíaca. O parasito pode estar en forma de tripomastigota no sangue humano ou de amastigota nos tecidos e de epimastigota nos insectos.
Os casos agudos trátanse con nifurtimox e benznidazole, pero non hai actualmente ningunha terapia efectiva contra os casos crónicos.
Trypanosoma cruzi je parazit, praživotinja bičaš koji uzrokuje bolest tripanosomijazu kod čovjeka i životinja, u Amerikama. Kod čovjeka se bolest koju uzrokuje ovaj organizam naziva Chagasova bolest.
![]() Nedovršeni članak Trypanosoma cruzi koji govori o biologiji treba dopuniti. Dopunite ga prema pravilima Wikipedije.
Nedovršeni članak Trypanosoma cruzi koji govori o biologiji treba dopuniti. Dopunite ga prema pravilima Wikipedije.
Trypanosoma cruzi er frumdýr sem veldur Chagi-sjúkdómi.
Il Trypanosoma cruzi è un protozoo parassita del genere Trypanosoma, portatore di infezioni e malattie, in particolare la malattia di Chagas (detta anche "tripanosomiasi americana").
T. cruzi viene trasmesso all'uomo dalla cimice Triatoma infestans, attraverso le sue feci. Tali emitteri, infatti, durante il nutrimento, defecano, irritando la pelle dell'uomo e provocando prurito. L'uomo favorisce quindi il contagio grattandosi, lasciando entrare in circolo il tripanosoma. Una volta penetrato, il parassita penetra in diverse cellule, soprattutto nei macrofagi, nelle cellule dei muscoli e in quelle nervose, dove si moltiplicano in forma amastigote trasformandosi successivamente in tripomastigote.
Il ciclo di vita del Trypanosoma cruzi inizia in un serbatoio animale, di solito mammiferi, selvatici o domestici, compresi gli esseri umani. Un insetto triatominae funge da vettore. Durante un pasto di sangue, ingerisce Trypanosoma cruzi. Nella cimice triatominae (Triatoma infestans) il parassita entra nello stadio di epimastigote, rendendo possibile la riproduzione. Dopo la riproduzione per fissione binaria, gli epimastigoti si spostano sulla parete cellulare del retto, dove diventano infettivi. I Trypanosoma cruzi infettivi sono chiamati tripomastigoti metaciclici. Quando l'insetto triatominae successivamente prende un pasto di sangue da un essere umano, defeca. I tripomastigoti sono nelle feci e sono in grado di nuotare nelle cellule dell'ospite usando flagelli, una caratteristica coda da nuoto dominante nella classe dei protisti euglene.
I tripomastigoti entrano nell'ospite umano attraverso la ferita da morso o attraversando le mucose. Le cellule ospiti contengono macromolecole come laminina, trombospondina, eparina solfato e fibronectina che ricoprono la loro superficie. Queste macromolecole sono essenziali per l'adesione tra parassita e ospite e per il processo di invasione dell'ospite da parte del parassita. I tripomastigoti devono attraversare una rete di proteine che rivestono l'esterno delle cellule ospiti per entrare in contatto e invadere le cellule ospiti. Le molecole e le proteine sul citoscheletro della cellula si legano anche alla superficie del parassita ed iniziano l'invasione dell'ospite.
Il Trypanosoma cruzi è un protozoo parassita del genere Trypanosoma, portatore di infezioni e malattie, in particolare la malattia di Chagas (detta anche "tripanosomiasi americana").
T. cruzi viene trasmesso all'uomo dalla cimice Triatoma infestans, attraverso le sue feci. Tali emitteri, infatti, durante il nutrimento, defecano, irritando la pelle dell'uomo e provocando prurito. L'uomo favorisce quindi il contagio grattandosi, lasciando entrare in circolo il tripanosoma. Una volta penetrato, il parassita penetra in diverse cellule, soprattutto nei macrofagi, nelle cellule dei muscoli e in quelle nervose, dove si moltiplicano in forma amastigote trasformandosi successivamente in tripomastigote.
Trypanosoma cruzi is een eencellige parasiet en de veroorzaker van de ziekte van Chagas. Het is een tropische vectorziekte, die voorkomt bij onder andere de mens en wel voornamelijk in Zuid-Amerika. Het is een protozoön en wordt overgebracht op mensen en andere zoogdieren door hoofdzakelijk de wants Triatoma infestans.
Trypanosoma cruzi werd voor het eerst in 1909 beschreven door de Braziliaanse arts Carlos Chagas en genoemd naar de arts Oswaldo Cruz.[1][2] Het eencellige diertje heeft een enkelvoudige flagel en een grote kinetoplast. De voor de soorten Kinetoplastea karakteristieke kinetoplast bestaat uit een grote DNA-structuur en bevindt zich in een groot mitochondrion.
De parasiet komt in meerdere verschijningsvormen voor, die morfologisch te onderscheiden zijn:
Op grond van biochemische onderscheidingstechnieken worden twee subtypen van T. cruzi onderscheiden. De relatief homogene typen I en II worden op grond van moleculairgenetische analyse verder onderverdeeld in IIa-e.[3] De typen, die toentertijd geen taxonomische rang hadden, onderscheiden zich niet alleen moleculair maar ook op grond van hun gastheer. De ondersoortaanduiding Trypanosoma cruzi cruzi voor alle humane isolaten wordt niet meer gebruikt. De ondersoort Trypanosoma cruzi marinkellei wordt uit Zuid-Amerikaanse vleermuizen geïsoleerd.
Trypanosoma cruzi komt voor in Zuid- en Midden-Amerika van Mexico tot het zuiden van Argentinië. Vooral in arme, landelijke gebieden komt de parasiet voor.[4] Besmette dieren worden echter ook in de Verenigde Staten aangetroffen.
De roofwantsen uit de onderfamilie Triatominae zijn een tussengastheer, speciaal uit de geslachten Rhodnius en Triatoma. De belangrijkste overbrenger op mensen is de wants Triatoma infestans. Van de zoogdieren zijn de hond en de kat, maar ook de in de omgeving van het huis levende knaagdieren en van de wilde dieren de opossums (voor T. cruzi type I) en gordeldieren (voor T. cruzi type II) de belangrijkste infectiebronnen.[5]
In de darm van roofwantsen verandert de met het bloed opgenomen parasiet van een trypomastigoot in een epimastigoot; deze kunnen zich door deling in het spijsverteringskanaal van de wants vermeerderen. In de endeldarm van de wants ontstaan uit de epimastigoten weer nieuwe trypomastigoten, die met de uitwerpselen uitgescheiden worden en zoogdieren via huidwondjes of het slijmvlies kunnen infecteren.
Bij zoogdieren komt de parasiet als trypomastigoot in de bloedbaan of als amastigoot in lichaamscellen voor. Na de infectie worden als eerste de macrofagen in de huid besmet. De intracellulaire amastigoten kunnen zich in het cytoplasma van de gastheercellen door deling vermeerderen en na omvorming in trypomastigoten de gastheercellen kapotmaken. Daardoor komen ze opnieuw in de bloedbaan en kunnen andere lichaamscellen van gewervelden, zoals hartspiercellen, of een nieuwe bloedzuigende roofwants infecteren.
Van mens op mens is ook overdraging van trypomastigoten door bloedtransfusie en orgaantransplantatie mogelijk. Ook kan de parasiet via de placenta van de moeder de foetus besmetten.
Het volledige DNA-gesequencingde genoom van Trypanosoma cruzi werd in 2005 gepubliceerd; het 60 megabasenpaar grote genoom is sterk repeterend en omvat ongeveer 12.000 verschillende genen.[6] De parasiet heeft aan het celoppervlak een glycocalyx van een complex sortiment van oppervlakkige antigenen, waaronder vele glycoconjugaten. Hierdoor komen in het genoom bijzonder veel genen voor trans-sialidasen voor, evenals andere voor het celoppervlak belangrijke stoffen zoals mucine en mucine-gerelateerde oppervlakteproteïnen[6] Ze spelen een belangrijke rol bij het omzeilen van het immuunsysteem van zoogdieren.
Er zijn slecht twee geneesmiddelen voor de bestrijding van de ziekte van Chagas, Nifurtimox en Benznidazol. Beiden werken door de vorming van vrije radicalen bij de stofwisseling, die door de parasiet wegens het ontbreken of geringe werking van de benodigde enzymen slecht kunnen worden afgebroken. Nieuwe middelen zijn door de genoomsequencing in ontwikkeling.[7]
Trypanosoma cruzi is een eencellige parasiet en de veroorzaker van de ziekte van Chagas. Het is een tropische vectorziekte, die voorkomt bij onder andere de mens en wel voornamelijk in Zuid-Amerika. Het is een protozoön en wordt overgebracht op mensen en andere zoogdieren door hoofdzakelijk de wants Triatoma infestans.
Świdrowiec amerykański (Trypanosoma cruzi) – kinetoplastyd z rodziny świdrowców należący do królestwa protista występujący w Ameryce Środkowej i Ameryce Południowej. U zwierząt, w tym człowieka wywołuje pasożytniczą chorobę Chagasa. W postaci trypomastigota trypanosoma występuje w osoczu krwi człowieka, natomiast w postaci amastigota występuje w komórkach układu siateczkowo-śródbłonkowego. Rezerwuar stanowią tutaj zwierzęta dzikie jak i domowe. Przenosicielem są pluskwiaki - to poprzez kał tych pasożytów zawierający metacykliczne trypomastigota zaraża się człowiek wcierając go przez spojówkę, uszkodzoną skórę bądź błonę śluzową jamy ustnej. Istnieje także zagrożenie wystąpienia zakażenia u noworodków poprzez ssanie mleka karmiącej matki.
Świdrowiec amerykański (Trypanosoma cruzi) – kinetoplastyd z rodziny świdrowców należący do królestwa protista występujący w Ameryce Środkowej i Ameryce Południowej. U zwierząt, w tym człowieka wywołuje pasożytniczą chorobę Chagasa. W postaci trypomastigota trypanosoma występuje w osoczu krwi człowieka, natomiast w postaci amastigota występuje w komórkach układu siateczkowo-śródbłonkowego. Rezerwuar stanowią tutaj zwierzęta dzikie jak i domowe. Przenosicielem są pluskwiaki - to poprzez kał tych pasożytów zawierający metacykliczne trypomastigota zaraża się człowiek wcierając go przez spojówkę, uszkodzoną skórę bądź błonę śluzową jamy ustnej. Istnieje także zagrożenie wystąpienia zakażenia u noworodków poprzez ssanie mleka karmiącej matki.
Trypanosoma cruzi é uma espécie de protozoário flagelado da família Trypanosomatidae. É o agente etiológico da doença de Chagas.
A espécie foi descrita em 1909 pelo médico brasileiro Carlos Chagas, como Trypanosoma cruzi.[2] O epíteto específico homenageia o médico epidemiologista Oswaldo Cruz.[3] No mesmo ano, Chagas recombinou-a em um novo gênero, o Schizotrypanum, após reconhecer particularidades biológicas no ciclo reprodutivo que a diferenciava das demais espécies do gênero Trypanosoma.[4] Em 1912, Delanoë e Delanoë descrevem o parasita Pneumocystis carinii,[5] demonstrando que as particularidades do ciclo reprodutivo observadas por Chagas eram na verdade de um outro parasita, fazendo com que Chagas retomasse o uso de Trypanosoma cruzi.[6][7]
Dentro do gênero Trypanosoma, a espécie está classificada na seção Stercoraria e no subgênero Schizotrypanum.[1] T. cruzi é politípico, com duas subespécies reconhecidas: Trypanosoma cruzi cruzi, agente da doença de Chagas, e o Trypanosoma cruzi marinkellei, encontrado apenas em morcegos no Continente americano.[8][9]
O T. cruzi ocorre naturalmente do sul dos Estados Unidos até a Argentina, sendo relativamente incomum na bacia amazônica.[10]
O T. cruzi é um protozoário unicelular e parasita obrigatório.[10] Possui um único flagelo e uma única mitocôndria, alongada e terminada num cinetoplasto, que contêm o DNA mitocondrial. Apresenta alternância de formas celulares durante seu ciclo biológico, sendo as principais: tripomastigota, forma em formato de C e flagelada; epimastigota, forma flagelada encontrada apenas no vetor, com capacidade reprodutiva; e amastigota, forma intracelular, sem flagelo, encontrada no hospedeiro vertebrado com capacidade reprodutiva.[11] É um protozoário pequeno medindo cerca de 16.3 - 21.8 μm de comprimento, incluindo o flagelo, na sua forma tripomastigota.[1]
A espécie possui um ciclo evolutivo heteroxênico, com hospedeiros vertebrados e invertebrados.[11] Em função desse ciclo digenético, Trypanosoma cruzi desenvolveu mecanismos adaptativos que permitem que o parasita sobreviva às diversas mudanças físico-químicas na passagem de um hospesdeiro para outro.
Os hospedeiros invertebrados são insetos da subfamília Triatominae, distribuída por todo o continente americano. Mais de 72 espécies foram encontradas com infecção natural por Trypanosoma cruzi, e outras 10 foram infectadas experimentalmente.[12] As espécies dos gêneros Triatoma, Rhodnius e Panstrongylus estão entre os principais vetores envolvidos na transmissão do T. cruzi.[13] Especificamente, cinco espécies são consideradas as mais notórias na transmissão da doença de Chagas, pela capacidade de colonizar e adaptar-se às habitações humanas, são elas: Triatoma infestans, Triatoma brasiliensis, Triatoma dimidiata, Panstrongylus megistus e Rhodnius prolixus.[10]
Ao contrário das outras espécies do subgênero Schizotrypanum, o T. cruzi tem um amplo espectro de hospedeiros, sendo reportada a infecção em mais de 150 espécies de mamíferos. Todos os mamíferos são considerados susceptíveis à infecção, enquanto aves e répteis aparentemente não são susceptíveis.[1] Marsupiais e tatus são os reservatórios silvestres mais importantes, enquanto cães, gatos, ratos e camundongos atuam como reservatórios domésticos.[11] As taxas de prevalência do T. cruzi em outros animais domésticos, como porcos, cavalos, bois e cabras, são geralmente muito baixas.[10]
T. cruzi está dividido em dois grandes grupos: T. cruzi I e T. cruzi II. Este último por sua vez se divide em cinco grupos menores: T. cruzi IIa, IIb, IIc, IId e IIe. T. cruzi II está mais associado aos casos crônicos a doença de Chagas, especialmente no cone sul da América do Sul.[15] O consenso mais recente[16] divide intraespecificamente em seis grupos gerais: TcI, TcII, TcIII, TcIV, TcV e TcVI. Cada grupo é predominante em regiões diferentes da América, sendo que a patogenicidade em humanos e a relação com cada grupo depende da região em que determinado isolado foi encontrado.
|seção= at position 43 (ajuda) !CS1 manut: Nomes múltiplos: lista de autores (link) Trypanosoma cruzi é uma espécie de protozoário flagelado da família Trypanosomatidae. É o agente etiológico da doença de Chagas.
Trypanosoma cruzi är en parasitisk protozo som enligt Arbetsmiljöverket har riskklass 3. Detta innebär att den klassas som ett smittämne med risk för allvarliga konsekvenser vid exponering.[1] Infektion av Trypanosoma cruzi är kronisk och en minoritet av de som bär på parasiten utvecklar Chagas sjukdom, ett sjukdomstillstånd som kan leda till döden.
Trypanosoma cruzi är en zoonos som kan överföras mellan däggdjur och människor via blodsugande insekter, en slags rovskinnbaggar (Reduviidae) i underfamiljen Triatomine. Människor som lever under primitiva förhållanden, trångt och smutsigt, riskerar dock att bli smittade av infekterade insekter. Dessa insekter suger blod från människan och domesticerade husdjur och producerar sedan avföring som är infekterad med parasiten. Sedan förs parasiten vidare genom att avföringen kommer i kontakt med sår på hud eller slemhinnor. Smittan kan även ske vid blodtransfusioner, organdonationer eller genom förtäring av mat som har blivit kontaminerad med avföring från infekterade insekter.[2][3][4]
Den första dokumentationen av Trypanosoma cruzi gjordes 1909 av Carlos Riberiro Justiniano Chagas, en brasiliansk läkare som först beskrev Chagas sjukdom.[5]
Historiskt sett har spridning och dödsfall kopplade till parasiten varit begränsade till den Latinamerikanska landsbygden där undermåliga levnadsförhållanden utgjorde goda förutsättningar för vektorer att frodas. De senaste årtiondena har dock framgångsrik bekämpning av ohyra lett till en minskning av parasiten på landsbygden men migration inom landet har istället lett till en spridning till städer både inom och utanför Latinamerika.
Sedan 1991 har stora ansträngningar gjorts för att minska förekomsten av vektorer i bostäder och 2007 bildades ett initiativ i Latinamerika vars syfte var att uppmärksamma globaliseringen av Chagas sjukdom som uppstått på grund av att smittan spridits med resenärer mellan kontinenterna. Trots de ansträngningar som gjorts räknas det med att 8 miljoner till 16-18 miljoner människor över hela världen redan har blivit smittade av Trypanosoma cruzi vilket innebär att Chagas sjukdom kommer att finnas kvar i årtionden framöver.[6][7]
Man vet inte säkert hur Trypanosoma cruzi har evolverat fram till dagens art men den kanske vanligast förekommande uppfattningen är att parasiten härstammar från en artrikare gren av trypanosomer som var specialiserade på fladdermöss. Enligt teorin ska dessa ha evolverat i fladdermössen för att sedan ta sig över till andra däggdjur. Ett alternativ till teorin är att föregångaren till Trypanosoma cruzi evolverade i fladdermöss för att sedan kunna infektera endast landlevande däggdjur. Det skulle kunna förklara den förvånansvärt sena men snabba spridningen av Chagas sjukdom hos människan.[8]
Forskare världen över har länge trott att Trypanosoma cruzi förökas klonalt och det är fortfarande vad man tydligast visat. Dock så har nyare studier visat tecken på rekombination och genetisk selektion. I vissa fall har man till och med kunnat utesluta direkt klonal överföring av gener.[9] Gener som man har visat påverkas av positiv selektion är loci som kodar för försvarsmekanimser mot värdens immunförsvar samt egenskaper som skulle kunna skydda patogenen från eventuellt framtida mediciner eller vaccin.[10]
I sin vektor återfinns Trypanosoma cruzi i två olika former. Parasiten överförs vid blodsugning och är då en rörlig metacyklisk trypomastigot. Väl inne i insektens matkanal omvandlas den till en epimastigot, vilket är parasitens replikationsstadium i vektorn. Efter delning tar den sig vidare till slutet av mag-tarmkanalen och omvandlas återigen till en metacyklisk trypomastigot.[2][11]
Då den smittade vektorn suger blod från ett däggdjur, exempelvis människa, bildas små sår. Genom såren kan insektens avföring, som innehåller trypomastigoter, komma in om värddjuret kliar sig till följd av bettet. Parasiten hamnar då i däggdjurets blodomlopp. En del av trypomastigoterna ligger kvar i blodomloppet och väntar på att en ny skinnbagge ska komma med nya spridningsmöjligheter. De allra flesta tar sig dock in i kroppscellernas cytoplasma för att utvecklas till amastigoter. I detta stadium är parasiten orörlig och delar sig obehindrat till dess att det inte får plats fler inne i cellen. Då omvandlas amastigoterna till rörliga trypomastigoter igen och frisätts till blodbanan då cellen spruckit till följd av att den överfyllts med patogener. Parasiten kan då ta sig in i en ny cell för att påbörja replikation på nytt, alternativt infektera en ny blodsugande vektor. Utan behandling pågår replikations-processen i värddjurets celler resten av dess liv, därför leder infektion till kroniska sjukdomstillstånd.[11][12]
Sjukdomar orsakade av Trypanosoma cruzi sprids framförallt från vektor till människa men kan även smitta mellan två människor vid blodtransfusion samt från mor till barn under graviditet.[13]
Trypanosoma cruzi är en parasitisk protozo som enligt Arbetsmiljöverket har riskklass 3. Detta innebär att den klassas som ett smittämne med risk för allvarliga konsekvenser vid exponering. Infektion av Trypanosoma cruzi är kronisk och en minoritet av de som bär på parasiten utvecklar Chagas sjukdom, ett sjukdomstillstånd som kan leda till döden.
Trypanosoma cruzi är en zoonos som kan överföras mellan däggdjur och människor via blodsugande insekter, en slags rovskinnbaggar (Reduviidae) i underfamiljen Triatomine. Människor som lever under primitiva förhållanden, trångt och smutsigt, riskerar dock att bli smittade av infekterade insekter. Dessa insekter suger blod från människan och domesticerade husdjur och producerar sedan avföring som är infekterad med parasiten. Sedan förs parasiten vidare genom att avföringen kommer i kontakt med sår på hud eller slemhinnor. Smittan kan även ske vid blodtransfusioner, organdonationer eller genom förtäring av mat som har blivit kontaminerad med avföring från infekterade insekter.
Trypanosoma cruzi Chagas, 1909
Trypanosoma cruzi (лат.) — вид одноклеточных организмов из семейства трипаносоматид. Видовое название дано Карлусом Шагасом, открывшим вид, в честь своего учителя — Освалду Круса[en].
Паразит человека и млекопитающих из отрядов: броненосцев, грызунов, опоссумовых, приматов, хищных и др. Тело изогнутое, сужается к концам клетки, сплющено в одной плоскости. Размер в длину составляет 1,5—2,0 мкм, толщина — 13—40 мкм. У микрооганизма имеется жгутик, в основании которого расположен кинетопласт. Размножается продольным делением надвое.
Trypanosoma cruzi (лат.) — вид одноклеточных организмов из семейства трипаносоматид. Видовое название дано Карлусом Шагасом, открывшим вид, в честь своего учителя — Освалду Круса[en].
Паразит человека и млекопитающих из отрядов: броненосцев, грызунов, опоссумовых, приматов, хищных и др. Тело изогнутое, сужается к концам клетки, сплющено в одной плоскости. Размер в длину составляет 1,5—2,0 мкм, толщина — 13—40 мкм. У микрооганизма имеется жгутик, в основании которого расположен кинетопласт. Размножается продольным делением надвое.
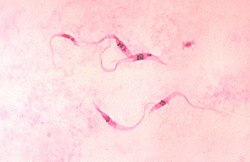
クルーズトリパノソーマ(学名:Trypanosoma cruzi)とは、鞭毛虫類キネトプラスト類トリパノソーマ属に属する原虫の1種であり、ヒトのシャーガス病の原因となる。サシガメにより媒介され、感受性動物はヒトを含む150種以上の哺乳類。米国南部、中南米に分布。ヒトにおけるシャーガス病の症状は発熱、全身性の浮腫、脾臓や肝臓の腫大、原虫血症、心筋炎、脳炎など。亜種に、Trypanosoma cruzi marinkellei Baker, Miles, Godfrey et Barret, 1978 がある[1]。
クルーズトリパノソーマ(学名:Trypanosoma cruzi)とは、鞭毛虫類キネトプラスト類トリパノソーマ属に属する原虫の1種であり、ヒトのシャーガス病の原因となる。サシガメにより媒介され、感受性動物はヒトを含む150種以上の哺乳類。米国南部、中南米に分布。ヒトにおけるシャーガス病の症状は発熱、全身性の浮腫、脾臓や肝臓の腫大、原虫血症、心筋炎、脳炎など。亜種に、Trypanosoma cruzi marinkellei Baker, Miles, Godfrey et Barret, 1978 がある。